
科目: 来源: 题型:
【题目】某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A. 黑色固体是碳
B. 钠在燃烧时只发生了一个反应
C. 钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO2![]() 2MgO+C)
2MgO+C)
D. 钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁加热至高温会分解,生成—种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
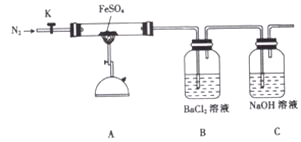
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却。
(1)已知M中铁元素的质量分数为70%,M的化学式为_____________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
操作步骤 | 实验现象 | 用方程式解释原因 |
打开K,通入一段时间N2,关闭K。加热A中玻璃管一段时间 | 洗气瓶B中①__________ | ②______________ |
A中固体不再分解后,停止加热,打开K,缓慢通入N2至玻璃管冷却 | 硬质玻璃管最终可以看到③_______________ | ④______________ |
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
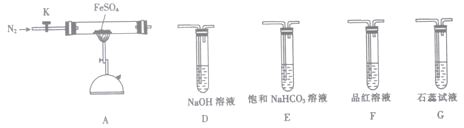
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→______→______。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”文中“盖泥法”的原理与下列相同的是( )
A. 活性炭净水 B. 用漂白粉漂白织物
C. 除去KNO3中的NaCl D. 除去河水中泥沙
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() 、Na+、K+。为了确认溶液的组成,进行了如下实验:
、Na+、K+。为了确认溶液的组成,进行了如下实验:
①取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。关于原溶液组成的结论,不正确的是( )
A. c(NH![]() )>c(SO
)>c(SO![]() )
)
B. 一定存在Cl-、SO![]() 、CO
、CO![]() 、NH
、NH![]() ,一定不存在Na+、K+
,一定不存在Na+、K+
C. c(CO![]() )=0.05 mol·L-1
)=0.05 mol·L-1
D. 至少存在四种离子,且c(Cl-)≥0.05 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性。将水合肼通入CuO胶体中,可发生如图所示的转化。

(1)图示的转化中,②属于_____________(填“非氧化还原反应”或“氧化还原反应”)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为_____。
(3)转化②中,反应一段时间后,溶液中n(OH-)____________(填“增大”“ 减小” 或“不变”)。
(4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象 | |||
装置 | 甲 | 乙 | 丙 |
|
|
| |
现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
A. 装置甲中的B金属是原电池的负极
B. 装置乙中的C金属是原电池的阴极
C. 装置丙中的D金属是原电池的正极
D. 四种金属的活泼性顺序是D>A>B>C
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质或用途的叙述中,正确的是
A.常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车
B.用氯化钡溶液可区别SO42-和CO32-离子
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.二氧化硅是一种酸性氧化物,它不跟任何酸发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】硫的多种化合物在工业中有重要的应用。
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为__________。
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为___________(填化学式)。
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2。该反应的化学方程式为____________________。
(2)铬会造成环境污染.某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg·L-1,达到排放标准。
①Na2S2O5参加反应的离子方程式为____________。
②处理后的废水中Cr3+的物质的量浓度为__________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com