
科目: 来源: 题型:
【题目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH时,应选用的试剂是
A.NaOHB.ZnOC.Na2CO3D.Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】计算题
(1)常温常压下,已知Ksp(AgCl)=1.8×10-10,Ksp(Mg(OH)2)=5.6×10-12试通过计算说明饱和AgCl溶液和Mg(OH)2溶液溶解度的大小;并且说明溶度积与溶解度之间的关系;[已知1.8=1.34,1.41/3=1.12]
(2)常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 mL和pH=3的某一元弱酸HA溶液20mL恰好完全反应生成NaA。试求:
①此一元弱酸的物质的量浓度。
②求此条件下该一元弱酸的电离平衡常数。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的保存方法正确的是( )
A. 金属钠保存在煤油中 B. 氢氧化钠保存在带玻璃塞的试剂瓶中
C. 漂白粉长期放置在烧杯中 D. 氯水保存在无色细口瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2在70℃的NaOH水溶液中能同时发生两个自身氧化还原反应,反应完全后,测得溶液中NaClO与 NaClO3物质的量之比为 4∶1,则溶液中 NaCl 与 NaClO 的物质的量之比为
A.9∶4 B.5∶1 C.11∶2 D.1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝、铁、铜四种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.Cu2+
B.AlO2-
C.Al3+
D.Mg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:

(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。
(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________________,直到滴定终点。滴定达到终点的标志是:_______________________________。
(4)根据下列数据,烧碱的纯度为:_______________________
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)判断下列操作引起的误差(填偏大、偏小或无影响)
①滴定前读数正确,滴定终点读数时仰视_________________
②装待测液前,锥形瓶内残留少量蒸馏水_______________
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(4)计算:血液中含钙离子的浓度为_____mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】由Mg、P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)基态Mg原子L层电子排布式为_____,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PH4Cl的电子式为_________,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
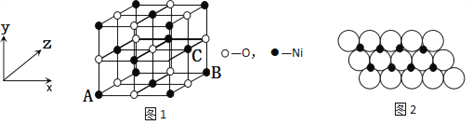
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g) ![]() 2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g) ![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将_______(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g) ![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
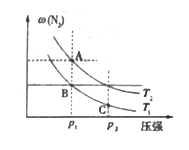
a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:

①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是
选项 | 实验器材 | 相应实验 |
A | 试管、铁架台、导管 | 乙酸乙酯的制备 |
B | 锥形瓶、漏斗、双孔塞、导管、带余烬的木条、药匙 | 检验MnO2对H2O2分解速率的影响 |
C | 500mL容量瓶、烧杯、玻璃棒、天平 | 配制 500mL1.00mol/LNaCl溶液 |
D | 三脚架、坩埚、酒精灯、坩埚钳 | 钠在空气中燃烧 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com