
科目: 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。
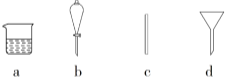
(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
(5)下面操作造成所配NaOH溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】侯氏制碱法:Ⅰ、原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________________。
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
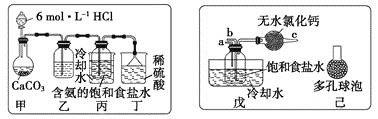
回答下列有关问题:
①乙装置中的试剂是________________;
②丁装置中稀硫酸的作用是________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________管通入_________气体,再从________管中通入________气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是________________________。
(3)请再写出一种实验室制取少量碳酸氢钠的方法_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
已知;
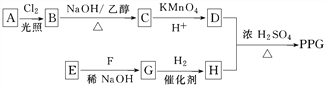
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质
④R1CHO+R2CH2CHO![]()
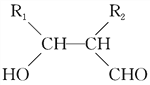
回答下列问题:
(1)A的结构简式为________。
(2)由B生成C的化学方程式为_________________________。
(3)由E和F生成G的反应类型为________,G的化学名称为________。
(4)①由D和H生成PPG的化学方程式为_______________________________________________________;
②若PPG平均相对分子质量为10 000,则其平均聚合度约为________(填标号)。
a.48 b.58
c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有________种(不含立体异构);
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应,
其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的是________(写结构简式);
D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填标号)。
a.质谱仪 b.红外光谱仪
c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中: 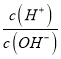 = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
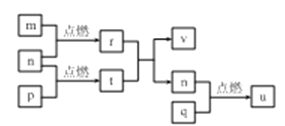
A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
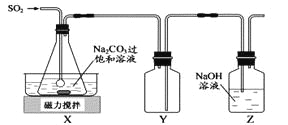
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目: 来源: 题型:
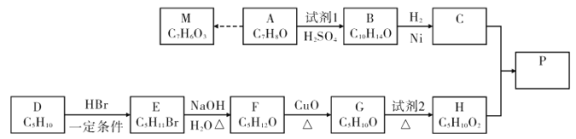
【题目】异戊酸薄荷酯(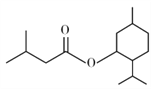 )是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
已知: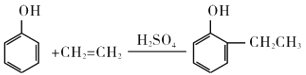 ;
;
![]()
完成下列问题:
(1)A的化学名称为____。试剂1的结构简式为____。
(2)由E生成F的化学方程式为____。
(3)试剂2可以是____试剂(填名称或化学式);该反应类型是 ____。
(4)由C和H生成P的化学方程式为____。
(5)M有多种同分异构体,写出所有满足下列条件的同分异构体的结构简式:____。
①属于酚类 ②能发生银镜反应
③核磁共振氢谱有4种峰、且峰值比为1:2:2:1
(6)苯乙烯是一种重要的化工原料。参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:___。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中不正确的是()
A. 电解时在电解池的阳极上不一定有阴离子放电
B. 原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C. 电解池是将电能转化为化学能的装置
D. 电解时,电源负极流出的电子数等于流入电源正极的电子数
查看答案和解析>>
科目: 来源: 题型:
【题目】二价铬不稳定,极易被氧化。醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O,是一种深红色晶体,微溶于乙醇,不溶于冷水和乙醚。实验室以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示:
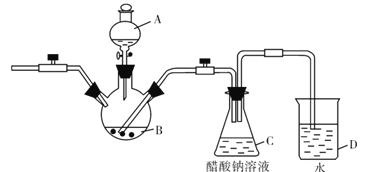
请回答下列问题:
(1)仪器A的名称是______,所盛装的试剂是_______。
(2)该实验中锌粒需过量,其原因除了与CrCl3充分反应得到CrCl2外,另一个作用是 ___________。
(3)写出C容器中制备醋酸亚铬水合物的离子方程式_______。
(4)仪器D的主要作用是_______。
(5)指出该装置的不足之处_______。
(6)Cr(OH)3的性质类似氢氧化铝,将CrCl3溶液蒸干灼烧,所得固体物质的化学式为_____。
(7)洗涤产品时,为了除去可溶性的杂质和水分,下列试剂正确使用的顺序是____(填序号)。
a.无水乙醇 b.冷的蒸馏水 c.乙醚
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是利用钛铁矿(主要成分FeTiO3)制金属钛的副产品,价格低。以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:
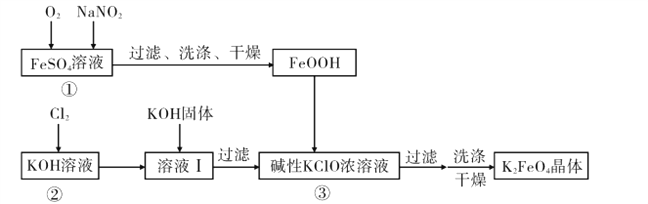
已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请问答下列问题:
(1)写出反应①生成铁黄(FeOOH)的离子方程式:__________________________________,
在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)“过滤、洗涤、干燥”制备铁黄时,检验铁黄表面已洗涤干净的操作是_____。
(3)写出反应③的化学方程式: ____。
(4)在溶液I中加KOH固体的目的是_____。
(5) K2FeO4可作为新型多功能水处理剂的原因是____。
(6)该工艺每消耗标准状况下ll2LCl2理论上得到____g K2FeO4。
(7)钛铁矿加入浓硫酸除生成TiOSO4外,还生成水和另外一种硫酸盐,且反应前后铁的化合价不变,化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com