
科目: 来源: 题型:
【题目】芳香烃A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体,A、B、C、D、E、F和OPA的转化关系如下所示:

已知:![]()
回答下列问题:
(1)A的化学名称是______。
(2)写出生成C所有可能的结构简式________________________________。
(3)OPA经中间体E可合成一种聚酯类高分子化合物F,写出E→F的反应的化学方程式______________________________________,该反应的反应类型是____________。
(4)用文字简述银氨溶液的配制方法:取lmL2%的__________溶液于洁净的试管中,然后边振荡边逐滴滴入2%的 ___________,至____________________________为止。
写出OPA与足金银氨溶液反应的离子方程式_______________________________________。
(5)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G任意一种可能的结构简式__________________。
(6)D(邻苯二甲酸二乙酯)是一种增塑剂。写出用A、合适的有机物及无机试剂为原料,经两步反应合成D的路线_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大, W与R同主族,且W的氢化物常温时为液态。X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子。
请用化学用语回答下列问题:
(1)Y、Z、W元素的氢化物沸点由高到低的顺序为____________(用化学式表示)。
(2)选取上述六种元素中的某些元素组成的化合物中,写出既含极性键又含非极性键,且相对分子质量最小的物质______________(写电子式)。该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为_______________________________。
(3)请用一个化学方程式证明W元素的非金属性强于R元素_________________________________。
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的Z4气态分子。Z4分子结构如图所示,己知断裂lmolZ-Z 吸收167kJ的热量,生成lmol Z![]() Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。
Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。

(5)①由X、Z、W三种元素形成的一种离子化合物,其水溶液中离子浓度由大到小的顺序是________________________。
②写出检验该化合物中阳离子的实验操作方法是_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.如果电子云图象是由两个s电子重叠形成的,即形成s-sσ键
B.水分子稳定性强是由于水分子中的氢氧键较为牢固
C.PCl5分子中各原子最外层均达到了8电子稳定结构
D.键角的大小与键长、键能的大小无关
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
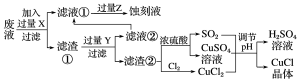
根据以上信息回答下列问题:
(1)写出生产过程中X___________,Y___________。
(2)写出产生CuCl的化学方程式:______________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:________。
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是______________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为___________,当pH较大时CuCl产率变低的原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25 g和10 mL过量的FeCl3溶液于250 mL锥形瓶中,充分溶解。
②用0.10 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl + FeCl3 === CuCl2 + FeCl2 、Fe2+ + Ce4+ === Fe3++ Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25 g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为___________(结果保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
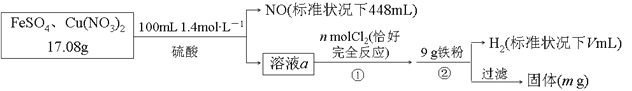
下列叙述中不正确的是
A. n=0.02 B. V=2240 C. m=3.2 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物在生产和生活中都发挥着重要的作用。
(1)SO2是形成酸雨的主要污染物,燃煤脱硫的原理为
2CaO(s)+2SO2(s)+O2(g)![]() 2CaSO4(s)
2CaSO4(s)
向10L恒温恒容密闭容器中加入3mol CaO,并通入2mol SO2和lmol O2发生上述反应,2min时达平衡,此时CaSO4为l.8mol。02min内,用SO2表示的该反应的速率v(SO2)=_________________;其他条件保持不变,若上述反应在恒压条件下进行,达到平衡时SO2的转化率________(“填大”、“减小”或“不变”)。
(2)25℃时,H2SO3的电离常数Kal=1×10-2, Ka2=6×10-8,则该温度下NaHSO3的水解平衡常数Kb=_____________。判断NaHSO3溶液显________性(填“酸”、“碱”或“中”),用简要文字叙述原因是_______________________________。
(3)Na2SO3溶液作为吸收液可脱除烟气中的SO2。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
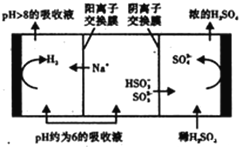
HSO3-在阳极放电时的电极反应式是________________________________。
(4)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g) △H>0
TaI4(g)+S2(g) △H>0
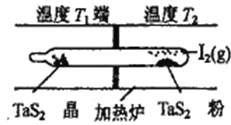
如上图所示,上述反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),—段时间后,在溫度为T1的一端得到了纯净的TaS2晶体,则温度T1 ______T2 (填“>”“<”或“=”)上述反应体系中循环使用的物质是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物CH3CH=CHCl不能发生的反应有( )
①取代反应;②加成反应;③消去反应;④聚合反应;⑤使溴水褪色;⑥使KMnO4酸性溶液褪色;⑦与AgNO3溶液生成白色沉淀
A.全部B.⑦C.⑥D.②
查看答案和解析>>
科目: 来源: 题型:
【题目】从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中 B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com