
科目: 来源: 题型:
【题目】对下列事实的解释错误的是
A. 氨气极易溶于水,氨气能够做“喷泉”实验
B. 常温下,浓硝酸可用铝罐来贮存,说明常温下浓硝酸不与铝发生反应
C. 向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性
D. 氯气不能使干的有色布条褪色,能使湿润的有色布条褪色,说明次氯酸具有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1mol HNO3的质量是____________, 1mol HNO3含有_____mol氧原子。
(2)标准状况下11.2L HCl气体溶于水中配成1L溶液,所得盐酸溶液的物质的量浓度是_______________。
(3)2mol OH 约含有__________________个电子。
(4)9.5gMgCl2固体溶于水配成500mL溶液,其中Cl-浓度为________mol· L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列有机物:①正丁烷,②异丁烷,③正戊烷,④异戊烷,⑤新戊烷。物质沸点的排列顺序正确的是( )
A.①>②>③>④>⑤B.⑤>④>③>②>①C.③>④>⑤>①>②D.②>①>⑤>④>③
查看答案和解析>>
科目: 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )

A. 该反应的逆反应是放热反应
B. 该反应在T1、T3温度时达到化学平衡
C. 该反应在T2温度时达到化学平衡
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】(1) 19.2g SO2在标准状况下的体积为___________L,其中含氧原子的物质的量为_______mol,该气体在标准状况下的密度是______________。
(2)0.5mol H3PO4的质量是_______g,含______个H3PO4分子,含______mol氧原子
(3)在标准状况下,将_______L NH3溶于水得到0.5 mol·L-1的氨水500 mL;配制100 mL 0.1 mol·L-1CuSO4溶液,需要CuSO4·5H2O________g。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________;
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
已知:①CO(g)+![]() O2(g)═CO2(g)△H1=akJ/mol
O2(g)═CO2(g)△H1=akJ/mol
②H2(g)+![]() O2(g)═H2O(g)△H2=bkJ/mol
O2(g)═H2O(g)△H2=bkJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H3=ckJ/mol
O2(g)═CO2(g)+2H2O(g)△H3=ckJ/mol
回答下列问题:
(1)△H= ______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
A.单位时间内生成1molCH3OH(g)的同时消耗了1molCO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 ![]() 的关系如图所示。
的关系如图所示。

①当起始 ![]() =2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)=________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)=________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始 ![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
(4)已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,则压强p1 ______p2(选填“>” “<” 或“=”);当压强为p2时,在y点:v(正) ______ v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp= ______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,则压强p1 ______p2(选填“>” “<” 或“=”);当压强为p2时,在y点:v(正) ______ v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp= ______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
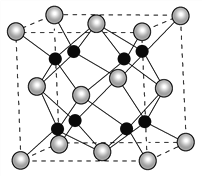
【题目】氧和钠能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______;晶胞中氧原子的配位数为________;列式计算晶体F的密度(g·cm-3)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】检验氯化氢气体中是否混有Cl2可采用的方法是( )
A. 用干燥的蓝色石蕊试纸 B. 用湿润的淀粉碘化钾试纸
C. 将气体通入硝酸银溶液 D. 用干燥的有色布条
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com