
科目: 来源: 题型:阅读理解
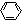 →
→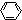 -CH2COOH+HCl
-CH2COOH+HCl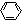 →
→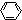 -CH2COOH+HCl
-CH2COOH+HCl| 卤代酸 | F3CCOOH | Cl3CCOOH | F2CHCOOH | FCH2COOH | CH3CH2CHClCOOH |
| pKa | 0.23 | 0.65 | 1.24 | 2.66 | 2.85 |
| 卤代酸 | ClCH2COOH | BrCH2COOH | ICH2COOH | CH3CHClCH2COOH | Cl③CH2CH2CH2COOH |
| pKa | 2.86 | 2.90 | 3.18 | 4.06 | 4.52 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
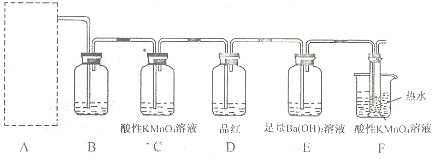
| 浓硫酸 |
| 浓硫酸 |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
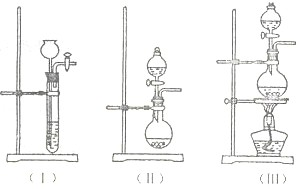
 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡查看答案和解析>>
科目: 来源: 题型:阅读理解
 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
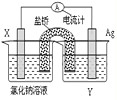
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.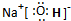
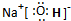
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com