
科目: 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 漂白粉、水玻璃、氨水均为混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】关于SO2和Cl2的叙述错误的是( )
A. 都是大气污染物 B. 都具有漂白性,能使有色物质永久性褪色
C. 水溶液都呈酸性 D. 在相同条件下密度都比空气大
查看答案和解析>>
科目: 来源: 题型:
【题目】将某份镁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中镁、铝物质的量之比为( )
A. 3∶2 B. 2∶1 C. 4∶3 D. 3∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaC13+6NH4HCO3= La2(CO3)3↓+6NH4Cl+ 3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
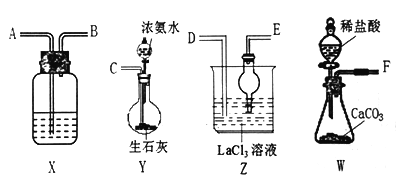
(l)盛放稀盐酸的仪器为____________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→___→___ →___ →___ →___ 。
(3)Y中发生反应的化学反应式为________________。
(4)X中盛放的试剂是_____,其作用为________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mLNH3 —NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y-=LaY-+2H+),消耗EDTA 溶液44.0 mL。则产品中La2(CO3)3的质量分数ω[La2(CO3)3]=_________。
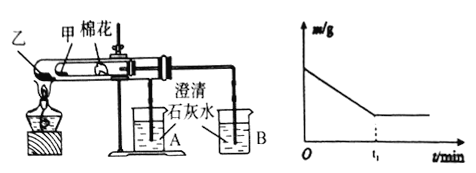
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为_______;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
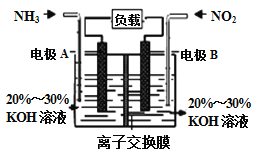
①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是
A. Na2S2O3溶液中滴入稀硫酸有淡黄色沉淀产生:S2O32-+2H+=H2O+SO2↑+S↓
B. 用石墨作电极电解AgNO3溶液:4Ag++2H2O![]() 4Ag+O2↑+4H+
4Ag+O2↑+4H+
C. 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2 (s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
D. 用食醋除去水壶中的水垢(CaCO3):2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的氯化氢分子数为NA
B.合成氨反应达平衡时,形成NA个![]() 键的同时,就有6NA个N—H键形成
键的同时,就有6NA个N—H键形成
C.1 mol乙烯分子中含有5NA个共用电子对
D.16 g CH4与18 g ![]() 所含的质子数均为10NA
所含的质子数均为10NA
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成
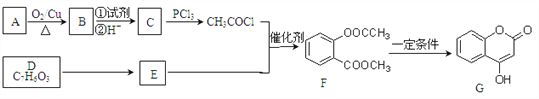
已知:RCOOH ![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
(1)A→B的反应类型是___________,B→C的转化所加的试剂①可能是______。
(2)E的结构简式为_________。
(3)F与足量NaOH溶液充分反应的化学方程式为_________________。
(4)写出同时满足下列条件的所有E的同分异构体的结构简式____________。
①能发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(5)己知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。
注:合成路线的书写格式参照如下示例流程图:________________________________
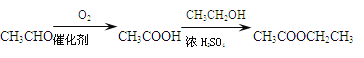
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com