
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色溶液中:Al3+、Cl-、MnO4-、SO42-
B. 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN-
C. Fe2+、NO3-、Cl-、Na-
D. H+、HCO3-、Ca2+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
移取10.00 mL密度为ρ g/mL的过氧化氢原溶液稀释成250 mL。量取稀过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(1)用高锰酸钾法(一种氧化还原滴定法)可测定待测液中的H2O2的含量。若需配制浓度为0.10 mol·L1的KMnO4标准溶液500 mL,应准确称取_________g KMnO4[已知M(KMnO4)=158.0 g·mol1]。
a.配制该标准溶液时,下列仪器中不必要用到的有_________。(用编号表示)。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
b.定容时仰视读数,导致最终结果__________(填“偏大”“偏小”或“不变”)。
(2)完成并配平离子方程式:
![]()
![]() +
+![]() H2O2+
H2O2+![]()
![]()
![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________________________。
(4)重复滴定三次,平均耗用KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果______________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学一选修3:物质结构与性质】
某原料经测定主要含有A、B、C、D、E五种原子序数依次增大的前四周期元素,其相关信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为_____。
(2) E的二价离子的电子排布式为_____。
(3) A2B2D4常用作除锈剂,该分子中B的杂化方式为_____;1 mol A2B2D4分子中含有σ键与π键的数目之比为_____。
(4) 与化合物BD互为等电子体的阴离子的化学式为_____(任写一种)。
(5) B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是___。
(6) 一种E和金(Au)形成的合金晶体具有面心立方最密堆积结构,其晶胞中E原子处于面心,Au原子处于顶点,则该合金中E原子与Au原子的个数之比为___;若相临两个Au原子的最短距离为a厘米,则该合金的密度为_____g/cm3。又知上述晶体具有储氢功能,氢原子可进入到由E原子与Au原子构成的四面体空隙中。若将E原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(见图)的结构相似,该晶体储氢后的化学式应为_____。
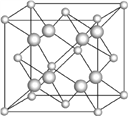
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
C. 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
D. 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.NH4+的电子式为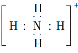 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目: 来源: 题型:
【题目】块状大理石与过量的3mol·L-1盐酸反应制取二氧化碳气体,若要增大反应速率,采取的措施中不合理的是
A.加入氯化钠固体B.改用6molL-1盐酸C.改用粉末状大理石D.适当升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各元素性质的递变规律错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B.pH=1的H3PO4溶液中,含有![]() 个
个![]()
C.2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com