
科目: 来源: 题型:
【题目】完成下列问题:
(1)下列物质中属于电解质的是_________;属于非电解质的是_________;既不是电解质也不是非电解质的是________________。
①稀硫酸 ②盐酸 ③NaCl固体 ④硫酸钡 ⑤CCl4 ⑥铜
⑦NaHCO3 ⑧CO2 ⑨HCl ⑩氨气
(2)写出下列反应的离子方程式
①NaCl+AgNO3===AgCl↓+ NaNO3: _____________________________________;
②HCl+CH3COONa=== CH3COOH+NaCl:_____________________________________;
③Ba(OH)2与H2SO4两稀溶液混合 :_____________________________________;
(3)写出下列反应的化学方程式(写两个)CO![]() +2H+===CO2↑+H2O:
+2H+===CO2↑+H2O:
①_____________________________________;
②_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下:
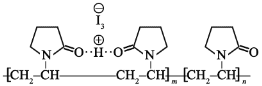 (图中虚线表示氢键)
(图中虚线表示氢键)
下列说法不正确的是
A.聚维酮的单体是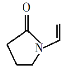
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程中不属于氮的固定的是( )
A.工业合成氨
B.雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐
C.用氨气与硝酸制成“硝铵”化肥
D.豆科作物的根瘤菌将空气中的氮转化为氨
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
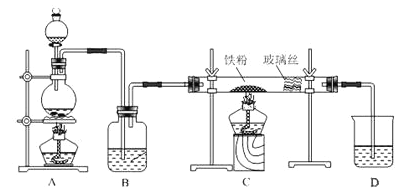
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取___________。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是___________。欲制得纯净的FeCl2,在实验操作中应先 ,再 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,写出该反应的化学方程式 ,CeO2在该反应中作__________剂。
(2)自然界中Cr主要以+3价和+6价存在,+6价的Cr能引起细胞的突变。现用亚硫酸钠溶液与0.1 mol K2Cr2O7反应,将其+6价的Cr完全还原为+3价的铬,则消耗1 mol/L亚硫酸钠溶液的体积为 L。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
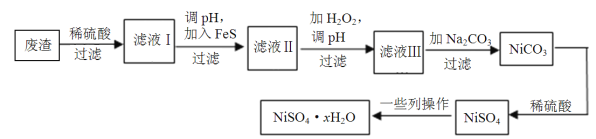
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质(已知溶解度FeS>CuS)。请写出除去Cu2+的离子方程式 。
②对滤液Ⅱ先加H2O2再调pH。加H2O2的目的是 ,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
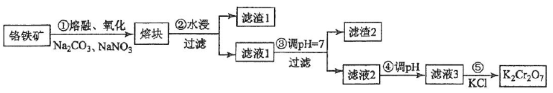
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是_________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________________(填标号)得到的K2Cr2O7固体产品最多。
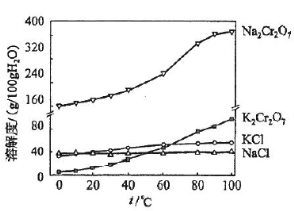
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)
砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的学%科网关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的学%科网关系如图所示。
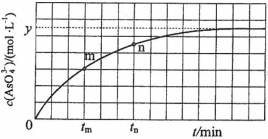
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黑火药是我国四大发明之一,黑火药爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作为氧化剂的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com