
科目: 来源: 题型:
【题目】下列描述中正确的是( )
A. 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个
B. 1L氢气一定比1L氧气质量少
C. 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42﹣的物质的量为3mol
D. 1molAl3+带有的正电荷数为1.806×1024个
查看答案和解析>>
科目: 来源: 题型:
【题目】下列试剂中,可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液的是
A. NaOH B. H2SO4 C. NH3·H2O D. AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组利用以下装置进行电解氯化铵溶液的实验,其中X为铁,Y为石墨,a为wg质量分数为40%的NH4Cl溶液(滴有酚酞)。
已知:①氧化性:Cl2> Br2>O2 > I2,②NH3+3CuO![]() 3Cu + 3H2O + N2
3Cu + 3H2O + N2
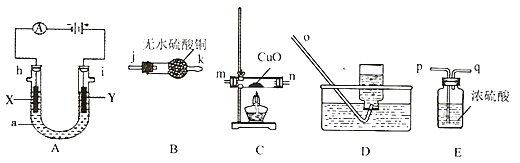
(l)电解过程中,A 装置中可观察到的现象是__________。
(2)请选用上述仪器,组装一套检验产生氢气的装置:_________[按气流方向(用“→”表示),用小写字母表示,装置不重复使用]。
(3)某同学认为将E换成装有碱石灰的干燥管也可以达到相同效果,乙同学认为不合理,其理由是________________。
(4)设计实验检测阳极产生的气体成分(除水蒸气外)。(所选的试剂用字母编号代替)限选试剂:A、3mol/LNaOH溶液 B、品红 C、酸化的淀粉-KI溶液 D、KBr溶液
操作 | 现象和结论 |
将混合气体依次通入________ | __________________ |
(5)电解结束后,加热电解液将NH3完全蒸出,并用水吸收形成200.00mL溶液,取出其中的20.00mL加指示剂后用标准浓度为c mol/L的盐酸溶液滴定,消耗盐酸V mL,则电解制得NH3的产率_________(用化简为整数的含w 、c 、V的代数式表示)。
(6)若实验时反接了正负极,则X极的电极方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是 (填序号)。
① 保存FeCl2溶液时,需向溶液中加入少量Fe
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④ 制备AlCl3、FeCl3、CuCl2均能采用将溶液直接蒸干的方法
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________;从腐蚀废液回收得到金属铜,还需要的试剂是__________________________。
(5)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a. NaOH溶液 b.氨水 c. CO2 d. 盐酸
(6)已知25 ℃时Ksp[Mg(OH)2]=5.6×1012,Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038,Ksp[Al(OH)3]=1.1×1033
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
③溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目: 来源: 题型:
【题目】[2017江苏]某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
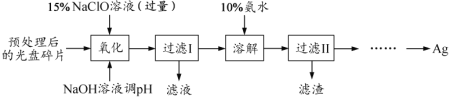
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O![]() Ag(NH3) 2++ Cl +2H2O
Ag(NH3) 2++ Cl +2H2O
③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4Ag(NH3) 2++N2H4·H2O![]() 4Ag↓+N2↑+4
4Ag↓+N2↑+4![]() +4NH3↑+H2O
+4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是__________________________________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为__________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有:2 mol·L1水合肼溶液,1 mol·L1H2SO4)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铁是般常用的金属之一,其铁合金及其化合物有着重要的用途。
(l)某种铁碳化合物X是炼钢的原料,经分析可知,X中铁、碳两元素的质量比为14:1,则X的化学式________;X在足量的空气中高温煅烧,生成有磁性的固体Y和能使澄消石灰水变浑浊的气体,该反应的化学方程式为___________________。
(2)铁钛合金是一种常用不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2Fe3++Fe=3Fe2+ ②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③_______________________。
(3)氧化铁是重要的工业原料,用废铁屑制备它的流程如下:
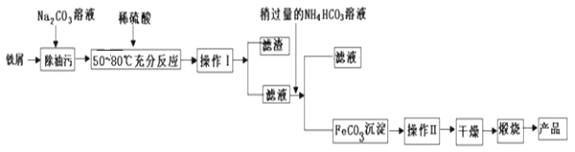
回答下列问题:
①操作Ⅱ的名称是_________。
②请完成生成FeCO3沉淀的离子方程式:_____________;FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L。试判断所得FeCO3固体是否混有Fe(OH)2:____(填“是”或“否”),请通过简单计算说明理由___________。
(已知Ksp[Fe(OH)2]=4.9×10-17mol3·L-3 、Ksp[FeCO3]=2.1×10-11mol2·L-2)
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。

A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
沸点/℃ | 64.7 | 7.4 | 153 | -24.9 | 90 |
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________。
(2)甲醇制甲醚的化学方程式为2CH3OH![]() CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
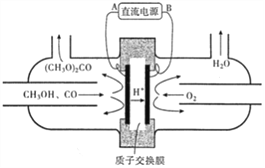
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________(填“A”或“B”),写出阳极的电极反应_________;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为
A. SiO2与NaHCO3 B. SiO2与Na2CO3 C. SiO2 D. Na2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com