
科目: 来源: 题型:
【题目】(15分)化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
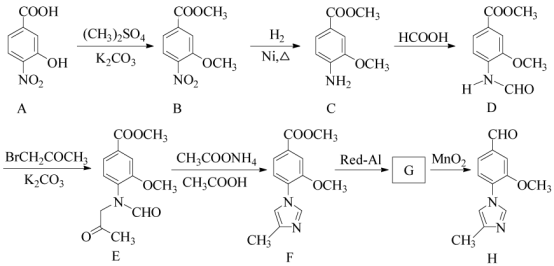
(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0. 2molNH3。下列对这四种气体相关量的比较不正确的是
A. 体积:②>③>①>④ B. 密度:②>③>④>①
C. 质量:②>③>①>④ D. 氢原子数:①>④>③>②
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
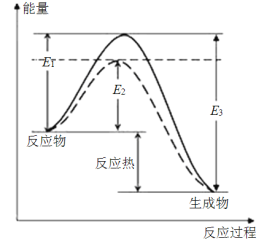
图1(图中表示生成1 mol物质时的能量)
根据图1请写出合成氨的热化学方程式:__________________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1 mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li![]() LiFePO4 ,电池正极反应为____________________。
LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
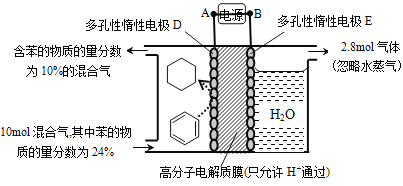
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目: 来源: 题型:
【题目】离子交换膜法为目前普遍使用的制碱技术,其生产流程如图l所示:
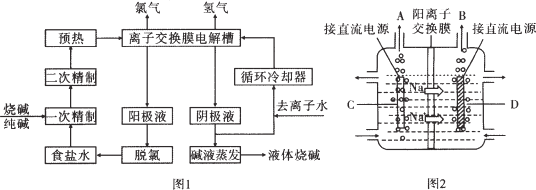
(1)氯碱工业中需用精制的食盐水,精制食盐水的目的是_________________________________。由于粗盐水中含有Ca2+、Mg2+、![]() 等无机杂质,在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式_______________________________。
等无机杂质,在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式_______________________________。
(2)该流程中可以循环的物质是__________。(写物质名称)
(3)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___________________________。
(4)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是__________,C电极的名称是__________。采用无隔膜电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________________________。
(5)已知在电解槽中,每小时通过I安培的直流电可以产生a克的烧碱。某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液b吨,电解槽的电流强度c安,该电解槽的电解效率为__________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[2016·新课标II卷]某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是__________(填离子符号);实验①和③说明:在I 过量的情况下,溶液中仍含有___________(填离子符号),由此可以证明该氧化还原反应为_____________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是____________________________________________;生成沉淀的原因是___________________________________(用平衡移动原理解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[2017海南卷]锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)用碳酸锂和_______反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为__________。
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是__________。
(3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是__________。
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF3和__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】饮茶在我国已有悠久的历史,深受许多人喜爱,因此有人称喝茶为“国饮”。茶叶中含有丰富的咖啡因(C8H10N4O2,相对分子质量为194),能兴奋中枢神经、消除疲劳。如果一壶茶含有0.194 g咖啡因,则其物质的量为( )
A. 4.00×10-3mol B. 3.00×10-3mol
C. 2.00×10-3mol D. 1.00×10-3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A. 钡可从氯化钠溶液中置换出金属钠
B. 钡可从冷水中置换出氢气
C. 钡可从硫酸铜溶液中置换出铜
D. 在溶液中Ba2+可氧化金属锌,生成Zn2+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:(HF)2(g) ![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
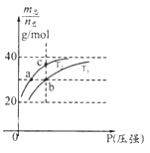
A. 温度:T1< T2
B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:v(b)>v(a)
D. 当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+ F2(g)===2HF(g)的能量变化如图所示,下列有关叙述中正确的是( )
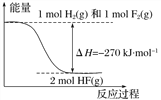
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H—H键和1 mol F—F键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com