
科目: 来源: 题型:
【题目】下列反应中原子利用率高,符合“绿色化学”要求的是
A. 乙烷与Cl2反应制氯乙烷
B. 乙醇和浓硫酸共热制乙烯
C. 乙酸和乙醇共热酯化
D. 乙烯在催化剂作用下直接氧化制得唯一产物乙醛
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1 mol N2和3 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。当反应达到平衡时,N2和H2的浓度之比是__________;当升高平衡体系的温度,则混合气体的平均式量________(填“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1 mol N2,H2的转化率__________(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡__________移动(填“正向”“逆向”或“不”)。
2NH3(g) ΔH=92.4 kJ·mol1。当反应达到平衡时,N2和H2的浓度之比是__________;当升高平衡体系的温度,则混合气体的平均式量________(填“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1 mol N2,H2的转化率__________(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡__________移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为__________,其溶于水能________水的电离(填“促进”或“抑制”),且使溶液的pH________(填“升高”“降低”或“不变”),原因是____________________________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2![]() 4NO(g)+6H2O(g) ΔH=905 kJ·mol1 ①
4NO(g)+6H2O(g) ΔH=905 kJ·mol1 ①
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=1268 kJ·mol1 ②
2N2(g)+6H2O(g) ΔH=1268 kJ·mol1 ②
①氮气与氧气反应生成NO的热化学方程式为__________________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是____________。

A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840 ℃之间
B.工业上采用物料比![]() 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900 ℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1 mol M在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则M的化学式为__________。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1 mol M,则电路中通过__________mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是

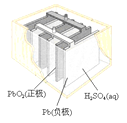
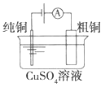
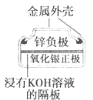
(a)碱性锌锰电池 (b)铅硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A.图(a)所示电池中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,硫酸浓度不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学一一选修3:物质结构与性质】过渡金属元素的单质及化合物在科学研究和工业生产中具有许多用途,根据所学知识回答下列问题:
(1)基态Ni2+的核外电子排布式_______________;配合物Ni(CO)4常温下为液态,易溶于CCl4,苯等有机溶剂,固态Ni(CO)4,属于_______________晶体;镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的价电子排布为3d10,则其杂化轨道类型为_______________,Ni(CO)4是_______________(填“极性”或“非极性” )分子。
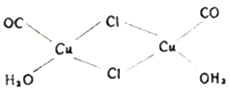
(2)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为_______________;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含_______________个配位键。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,(SCN)2 分子中含有σ键与π键的数目比为__________; 类卤素 (SCN)2 对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______________。
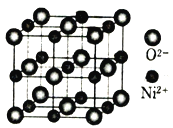
(4)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为_______________g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。
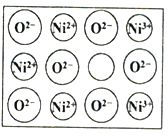
人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,B在常温下为气体,C俗名称为烧碱,D为无色无味液体
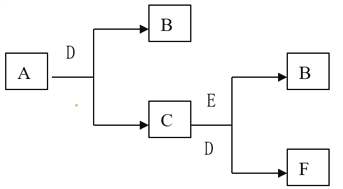
(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________________。
(3)写出E与C、D反应生成的B和F离子方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
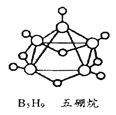
【题目】(1)2008年北京奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类化学物质也好似鸟巢,如化学式是B5H9的五硼烷(如图)。 请问五硼烷的摩尔质量是____g/mol。

(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为______,质量之比为______,密度之比为________。
现有三组混合物:①溴水 ②39%的乙醇溶液(乙醇的沸点为78.4℃)③汽油和氯化钠溶液,分离以上各混合物的正确实验方法依次是_______ 、________、_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的产品。
治理方案Ⅰ:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:_______________、_______________。
治理方案Ⅱ:
某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既去除尾气中的SO2,又制得电池材料MnO2 (反应条件已省略)。
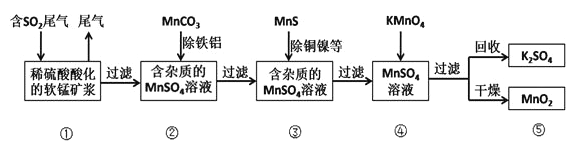
请回答下列问题:
(2)用MnCO3能除去溶液中Al3+和Fe3+其原因是___________________________,用MnS除去溶液中的Cu2+的离子方程式为_______________。
(3)流程图④过程中发生的主要反应的化学方程式为___________________。
(4)MnO2可作超级电容器材料。工业上用下图所示装置制备MnO2。接通电源后,A电极的电极反应式为:_______________,当制备lmol MnO2,则膜两侧电解液的质量变化差(△m左-△m右)为_______________g。

查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol1
2NO2(g) ΔH=113.0 kJ·mol1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH= kJ·mol1。
SO3(g)+NO(g)ΔH= kJ·mol1。
一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
A.体系密度保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶5,则平衡常数K= 。
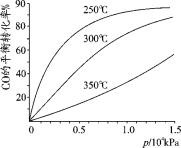
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)如图是一种用NH3脱除烟气中NO的原理。
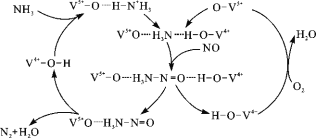
①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为 L。
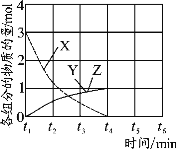
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是()
A. Na+、Cu2+、Cl-、SO42― B. Ba2+、K+、OH-、NO3―
C. K+、Ca2+ 、NH4+、CO32― D. H+、Ca2+、Cl-、HCO3―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com