
科目: 来源: 题型:
【题目】[2017新课标Ⅰ]Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
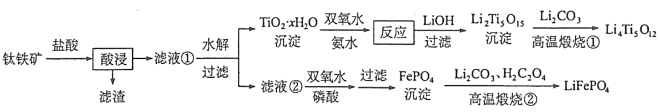
回答下列问题:
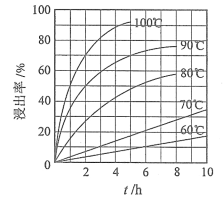
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式__________________。
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋约占地球表面积的71﹪,具有十分巨大的开发潜力。
(1)海水中溶解无机碳占海水总碳的95%以上,主要以HCO3﹣形式存在,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用滴定的方法:取20mL海水于锥形瓶中,用__________盛装x molL﹣1HCl标准溶液滴定,消耗y mLHCl溶液,则海水中溶解无机碳的浓度=_______molL﹣1。

(2)在体积可变的恒压(P0)密闭容器中,一定量的CO2与足量的碳反应:C(s)+CO2(g)2CO(g)。平衡时,体系中CO2和CO气体体积分数与温度的关系如图所示。
(已知:气体分压=气体总压×气体体积分数。)请回答下列问题:
①C(s)+CO2(g)2CO(g) ΔH____0(填“﹦”,“<”或“>”)。
②550℃时,若充入惰性气体,平衡_____(填“正向移动”,“逆向移动”或“不移动”)。
③650℃时,反应达平衡后CO2的转化率为__________。
④925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=______________。
(3)在固态金属氧化物电解池中,高温共电解H2O﹣CO2混合气体制备H2和CO是一种新
的能源利用方式,基本原理如图所示。其中X是电源的__________极(填“正”
或“负”),阴极的反应式是:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一。根据下表数据判断,不宜用上述方法制取合金的是( )
金属 | Na | Al | Cu | Fe |
熔点(℃) | 97.81 | 660 | 1 083 | 1 535 |
沸点(℃) | 883 | 2 200 | 2 595 | 3 000 |
A. Fe-Cu合金 B. Cu-Al合金 C. Al-Na合金 D. Cu-Na合金
查看答案和解析>>
科目: 来源: 题型:
【题目】①20g NaOH溶于水形成500mL溶液,所得溶液的物质的量浓度是_________mol/L。
②标准状况下,44.8LNH3溶于水形成1L溶液,所得溶液的物质的量浓度是_____mol/L。
③配制500mL 0.5 molL-1的盐酸,需要标准状况下的HCl气体多少_____升?
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是 ( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目: 来源: 题型:
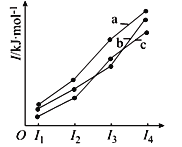
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
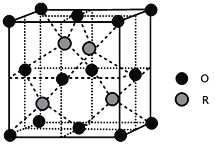
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)
(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com