
科目: 来源: 题型:
【题目】实验室要配制480mL 0.2 mol·L-1 NaCl溶液,实验室只有含有少量硫酸钠的氯化钠样品,设计如下方案,请回答下列问题:
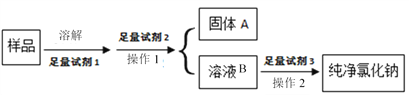
Ⅰ.粗盐提纯
(1)固体A的成分为________________(填化学式)。
(2)试剂2的化学式为_____________,判断试剂2是否过量的方法_______________,操作2的名称__________________。
Ⅱ.配制溶液
(1)用托盘天平称取氯化钠,其质量为________g。
(2)配制过程中需要使用的实验仪器除了托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管外,还需要___________。
(3)下列主要操作步骤的正确顺序是①—____—_____— ____—④(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
③将溶液转移到容量瓶中
④盖好瓶塞,反复上下颠倒,摇匀
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中
(4)下列情况对所配制的NaCl溶液浓度有何影响?(选填“偏大”、“偏小”或“无影响”)
①容量瓶用蒸馏洗涤后残留有少量的水________________;
②定容时,仰视容量瓶的刻度线________________;
③转移溶液时,玻璃棒的下端靠在容量瓶的刻度线以上的内壁________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X(HOOC-CH(OH)-CH2-COOH)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内含量较多。
(1)有机物X中含有的官能团名称是__________________;
在一定条件下,有机物X可发生化学反应的类型有________(填字母)。
A.水解反应 B.取代反应
C.加成反应 D.消去反应
E.加聚反应 F.中和反应
(2)写出X与金属钠发生反应的化学方程式:____________。
(3)与X互为同分异构体的是________(填字母)。
a.CHHOOCOHCH2CH2CH2COOH
b.CHHOOCOHCHOHCHO
c.CHHOOCOHCOOCH3
d.H3COOCCOOCH3
e.CHH3COOCOH(CH2)4COOCH3
f.CHOHH2COHCHOHCOOH
查看答案和解析>>
科目: 来源: 题型:
【题目】请计算并填空:
(1)含有相同氧原子数的CO和CO2 ,其分子数之比为__________________。
(2))在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,该金属原子的摩尔质量为___________。
(3)48g CH4与标准状况下 ____________L NH3所含H原子个数相等。
(4)在0.4L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,该混合溶液中,含溶质MgCl2的质量为________g;将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为________mol·L-1。

查看答案和解析>>
科目: 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供孤电子对的成键原子是_____。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
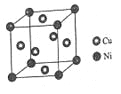
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加徳罗常数的值,下列说法中正确的是
A. 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1 NA
B. 常温常压下,36g 18O2中所含的中子数为16 NA
C. 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2 NA
D. 标准状况下,11.2LH2O中含有H—O键的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年铁道部发布了《关于严禁旅客携带易燃、易爆危险品进站上车紧急报告》,对旅客安全运输工作提出了更加严格的要求。下列物质可以在乘车、船或飞机时较大量随身携带的是( )
A. 硫酸钾 B. 高锰酸钾 C. 硫黄 D. 硝酸钾
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
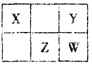
A. 简单离子半径:W>Z>Y
B. 简单气态氢化物的稳定性:Y >Z > W
C. 最高价氧化物对应的水化物酸性:W >Z
D. 若W的最高正价为+ m,则Y的最高正价也一定为+m
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 3 mol·L-1的KClO3 B. 75 mL 2 mol·L-1的NH4Cl
C. 350 mL 3 mol·L-1的NaCl D. 150 mL 0.5mol·L-1的CaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所示实验,现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
B | 常温下,测定等物质的量浓度的 Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
C | 向某溶液中加入硝酸酸化的氯化钡溶液 | 溶液中有白色沉淀生成 | 该溶液中含有SO42- |
D | 向FeCl3和KSCN混合溶液中,加入少量KC1固体 | 溶液颜色变浅 | FeCl3+3KSCN |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知离子反应:RO3n -+ 6I- + 6H+ = R- + 3I2 + 3H2O,则R元素在RO3n-中的化合价是( )
A. +1 B. +2 C. +4 D. +5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com