
科目: 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是
A、体积比为1:1 B、体积比为11:16
C、物质的量比为16:11 D、密度比为11:16
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液。若Cl2与KOH溶液反应时,被还原与被氧化的氯元素物质的量之比是11︰3,则混合液中ClO-与ClO3-的物质的量之比是( )
A.1︰1 B.1︰2 C.1︰3 D.2︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】双酚A型环氧树脂广泛应用于涂料、玻璃钢、包封等领域,可由下列路线合成制得(部分反应条件和产物略去):
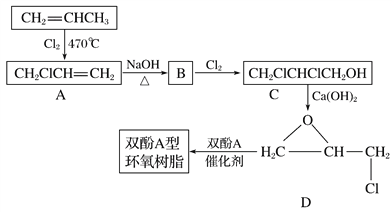
已知:二酚基丙烷简称双酚A,双酚A型环氧树脂的结构简式为
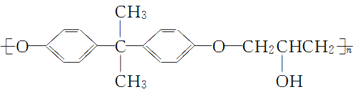
回答下列问题:
(1)A含有的官能团结构简式为___________,C的化学名称为___________。
(2)A→B的反应类型为________,双酚A的核磁共振氢谱共有_____个吸收峰。
(3)分子中不含碳碳双键的D的同分异构体(不考虑立体异构)共有__________种。
(4)写出由D和双酚A合成双酚A型环氧树脂的化学方程式:____________________。
(5)参照双酚A型环氧树脂上述合成路线,设计一条由环戊二烯![]() 为起始原料制备
为起始原料制备![]() 的合成路线。__________
的合成路线。__________
查看答案和解析>>
科目: 来源: 题型:
【题目】同一周期的X、Y、Z三种元素,已知它们最高价氧化物对应水化物的酸性强弱是H3XO4<H2YO4<HZO4,下列推断不正确的是( )
A. 原子序数:X<Y<Z B. 气态氢化物稳定性:XH3<H2Y<HZ
C. 元素的非金属性强弱:X>Y>Z D. 最外层电子数:Z>Y>X
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A 为红棕色气体,B为强酸,X为常见金属单质。
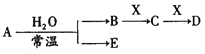
(1) C的化学式为____________。
(2) A与水反应的化学方程式为____________。
(3)某温度下(>100℃)若mgX与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
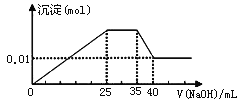
根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的( )
A.(NH4)2SO4 B.NH4NO3 C.NH4Cl D.NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】由环己烷可制得1,4-环己二醇,下列有7步反应(其中无机产物都已略去),试回答以下问题:
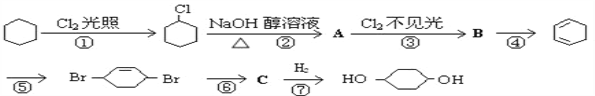
(1)上述反应中属于加成反应有________________________。
(2)化合物的结构简式:B________________________;
(3)反应⑥所用试剂和条件是________________________;
(4)写出反应②、⑤的化学方程式:
反应②____________________________________________________;
反应⑤____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题
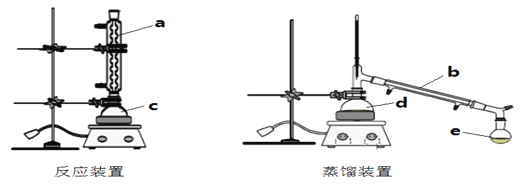
(1)写出合成乙酸乙酯的化学方程式_______________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 _______________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏。
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接好装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知:乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) |
| 338.0 | 1.84 |
(1)配制反应混合液的主要操作步骤为_______________________(不必指出液体体积);制取乙酸乙酯的化学方程式为________________。
(2)上述实验中饱和Na2CO3溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.减小乙酸乙酯的溶解度,有利于其分层析出
D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是________________________________________________________。
(4)写出步骤③中观察到的现象___________________________。
(5)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤。通过洗涤可除去的杂质是________(填名称);干燥乙酸乙酯可选用的干燥剂为________(填字母)。
A.P2O5 B.无水硫酸钠
C.碱石灰 D.NaOH固体
(6)某化学课外小组设计了图乙所示的制取乙酸乙酯的装置(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有________(填字母)。
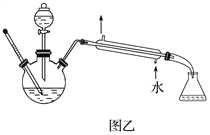
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液,减少反应物蒸发
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com