
科目: 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
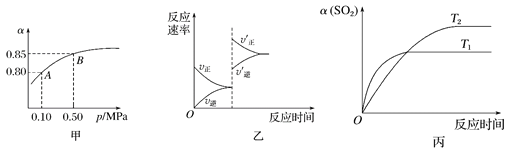
A. 由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B. 由图甲知,A点对应温度下的平衡常数为80
C. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
D. 达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
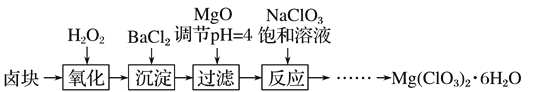
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 。
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于化学反应与能量的说法正确的是
A. 燃烧属于放热反应 B. 中和反应是吸热反应
C. 形成化学键时吸收能量 D. 反应物总能量与生成物总能量一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H______(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
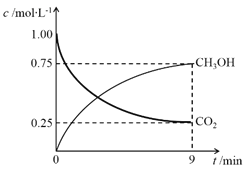
① 该反应化学平衡常数K的表达式是____________________。
②0~9min时间内,该反应的平均反应速率ν(H2) =_______。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0< Q <29.5 b. 29.5< Q <36.75 c. 36.75< Q <49 d. 49< Q <98
④在一定条件下,体系中CO2的平衡转化率(α)与L和 X的关系如图所示,L和X分别表示温度或压强。
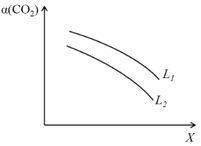
i. X表示的物理量是:_____________。
ii. 判断L1与L2的大小关系,并简述理由:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A. 浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌
B. 浓硫酸不分解,不挥发,所以可以敞口放置于空气中
C. 浓硫酸具有氧化性,稀硫酸无氧化性
D. 可以用铁罐或铝槽车来运输冷的浓硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将___________中(填“增大”、“减小”或“不变”),溶液中![]() 比值___________(填“增大”、“减小”或“不变”).
比值___________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=___________.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置,可以完成许多电化学实验。下列有关此装置的叙述中,正确的是
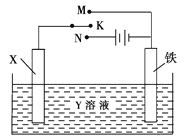
A.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中阳离子向碳棒电极移动
C.若X为碳棒,Y为硫酸铜溶液,开关K置于M处,碳棒质量将增加,此时外电路中的电子向碳电极移动
D.若X为铜棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有SO42-、 CO32-、Cl-、SO32-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )。
A. H2SO4 B. HCl C. NaOH D. HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若质量相等,则质子数相等 B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积相等 D. 若体积相等,则密度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com