
科目: 来源: 题型:
【题目】铁与人类生活密切相关,几乎无处不在,是含量仅次于铝的金属,是现代化学工业的基础。请回答下列问题。
(1)已知:①3Fe(s)+2O2(g)![]() Fe3O4(s) ΔH1=1118.4 kJ/mol
Fe3O4(s) ΔH1=1118.4 kJ/mol
②2H2(g)+O2(g)![]() 2H2O(g) ΔH2=483.8 kJ/mol
2H2O(g) ΔH2=483.8 kJ/mol
写出铁与气态水反应的热化学方程式:________________________。等量的铁与足量的液态水反应比与气态水反应的反应热ΔH_________(填“大”或“小”)。
(2)在t℃时,在2 L恒温恒容密闭容器中,按下表所示加入物质,反应经过一段时间后,压强变为原来的两倍。
Fe | H2O(l) | Fe3O4 | H2 |
2.0 mol | 4.0 mol | 1.0 mol | 1.0 mol |
容器中H2O(l)的转化率为________。
(3)在25℃下,Ksp[Fe(OH)3]=4×1038,向浓度为0.1 mol·L1的FeCl3溶液中逐滴加入氨水,调节溶液pH为5时,溶液中c(Fe3+)为_______mol·L1。
(4)某温度时,向某密闭容器中加入足量铁粉并充入一定量的CO2,发生反应 Fe(s)+CO2(g)![]() FeO(s)+CO(g),c(CO2)与t的关系如图所示:
FeO(s)+CO(g),c(CO2)与t的关系如图所示:
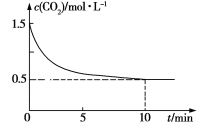
①该条件下反应的平衡常数为__________;
②已知升温能导致平衡常数K增大,该反应的ΔH_____0(填“>”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )
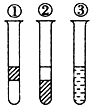
A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
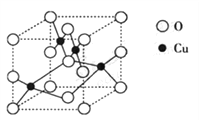
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______。
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
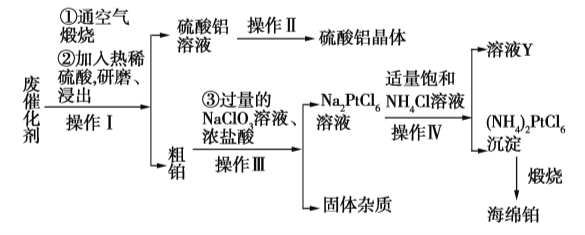
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2![]() AlY+2H+,H2Y2+Zn2+
AlY+2H+,H2Y2+Zn2+![]() ZnY2+2H+)
ZnY2+2H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.同一原子中,轨道的能量高低:1s>2s>3s>4s
B.同一原子中,轨道的能量高低:3d<3p<3s
C.不同能级中含有的原子轨道数:s-2;p-6;d-10
D.M 层上所具有的原子轨道数共有 9 个
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关。 回答下列问题:
(1)前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为________________。
(2)N2F2分子中氮原子的杂化方式是_________,1molN2F2含有______mol σ键。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1molNH4BF4含有___________mol配位键。
(4)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点大小关系为 _____>_____(用化学式表示),![]() 的沸点比
的沸点比 ____(填“高”或“低”);原因是______________________。
____(填“高”或“低”);原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置不能达到有关实验目的是
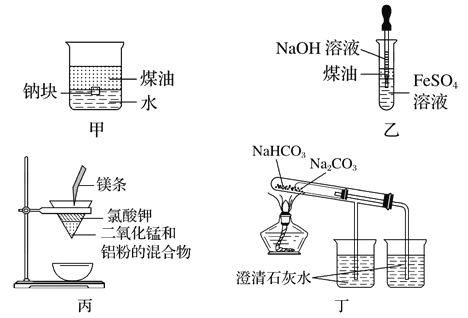
A. 用甲图装置证明密度ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
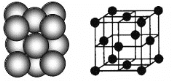
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com