
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
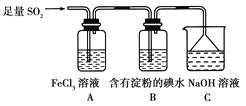
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 硫化氢在空气中燃烧 D. 高温煅烧硫铁矿
(2)装置C的作用是______________________________。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、________、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(4)①写出SO2与FeCl3溶液反应的离子方程式:______________________________;
②请设计实验方案检验反应后A中Fe2+生成______________________________;
③本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【双流中学2017届下学期第二次适应性考试】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
A.98%的浓硫酸 B.1%的品红溶液 C.1.0 mol·L-1的KI-淀粉溶液
D.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度___mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】【厦门第一中学2017届考前模拟】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。
I.实验室制备卤砂:所需装置如下,装置可重复选用。

(1)装置接口连接顺序是_________→a;b←_________。
(2)C装置的作用是___________,D装置盛装的物质是_________________。
(3)写出用上述装置制备氨气的一组试剂:_________________。
Ⅱ.测定卤砂中C1元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按下图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。
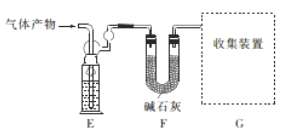
(4)E装置内的试剂为________________。
卤砂与氧化铜混合加热反应的化学方程式为________________。
(5)卤砂中Cl元素和N元素的质量之比为_________(用含b、v的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol则被氧化的NH3在标准状况下的体积为__________L.
II.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol.L-1稀硫酸,
实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④检漏、转移、洗涤⑤定容、摇匀。若实验仪器有:A.100mL量筒 B.托盘天平C.玻璃棒D.50mL容量瓶 E.10mL量筒F.胶头滴管G.50mL烧杯H.100mL容量瓶
回答下列问题:
(1)需量取浓硫酸的体积为___________mL.
(2)实验时选用的仪器有___________(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是___________(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④所用的浓硫酸长时间放置在密封不好的容器中⑤用量筒量取浓硫酸时仰视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】【山东省实验中学2017届下学期第二次模拟考试】(14分〕某化学兴趣小组欲探究含硫物质的性质及制备。
【探究一】用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
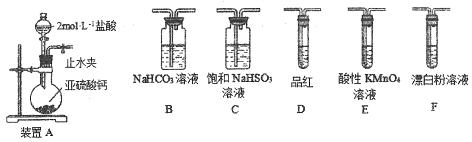
装置连接顺序为_________(用字母表示),其中装置C的作用是___________。
【探究二】
(1)某小组同学为探究SO2的漂白性性质,用下图所示装置进行实验,
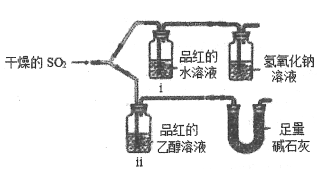
观察到如下现象:i中红色褪去;ii中无变化.碱石灰的作用除了吸收尾气外还有_______的作用。从实验中可知使品红的水溶液褪色的微粒可能是____________。
(2)该小组同学又对SO2与氯水的反应进行探究。
①用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色。②改变氯水用量,重复①操作,发现品红溶液红色褪去,你认为②中品红溶液褪色的原因可能是__________。 设计一个实验(说明操作方法、现象及结论)来验证你的假设________。
【探究三】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(1)制取Na2S2O4常用甲酸钠法。控制温度70-80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液酸性,即可生成Na2S2O4,反应的离子方捏式________。
(2)测定保险粉纯度。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.10mol·L-1的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL.则该样品中Na2S2O4的质量分数为______ (杂质不参与反应)。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。下列有关H2S的说法正确的是
A.H2S属于非电解质 B.人体内H2S可由含硫蛋白质降解产生
C.大量吸入H2S对人体无害 D.H2S只有还原性没有氧化性
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
硫酸 化学纯(CP)(500 mL)
品名:硫酸 化学式:H2SO4
相对分子质量:98 密度:1.84 g·mL-1
质量分数:98%
(1)该浓硫酸中H2SO4的物质的量浓度为______________mol/L。
(2)某学生欲用上述浓硫酸和蒸馏水配制250 mL物质的量浓度为1.84mol/L的稀硫酸。他需要量取___________mL上述浓硫酸进行配制,需要的玻璃仪器除了烧杯、玻璃棒,50mL量筒,还有___________________________________。配制时,其正确的操作顺序是___________(用字母表示,每个字母只能用一次)。
A.用少量蒸馏水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡。
B.先在烧杯中加适量蒸馏水,再把量好的浓硫酸沿玻璃棒倒入烧杯中,搅拌均匀。
C.将已冷却的溶液沿玻璃棒注入容量瓶中。
D.将容量瓶盖紧,振荡,摇匀。
E.继续加水至离刻度线1-2厘米处,改用胶头滴管加水,使凹液面恰好与刻度线相切。
F.将配制好的溶液装进试剂瓶,并贴上标签。
(3)假设该同学取了50mL新配的稀硫酸,与1.0mol/L的Ba(OH)2溶液反应,当恰好沉淀完全时,发现实际用去Ba(OH)2溶液的体积比理论需要的少,则可能的原因是______________。
A.用量筒量取浓硫酸时操作太慢,吸收了空气中的水蒸气
B.量取浓硫酸时,俯视量筒刻度线
C.配制溶液时,俯视容量瓶刻度线
D.在烧杯中稀释浓硫酸后立刻转移到容量瓶中
E.装进试剂瓶时,有少量溶液洒出瓶外
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.
Ⅰ.某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:

(1)反应①的离子方程式为__________________。
(2)操作①中用到的玻璃仪器是_______________(填序号)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是_________________(填名称)。
(4)原料②的名称为__________________。
Ⅱ.已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:_______________________,用双线桥标出上述反应的电子得失____________________________________。在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH=2,则在反应中转移电子的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】甲乙两实验小组同学对铁及其化合物的性质进行如下探究:
I.甲组同学利用如图装置探究过量铁粉与浓H2SO4反应产生的气体成分。
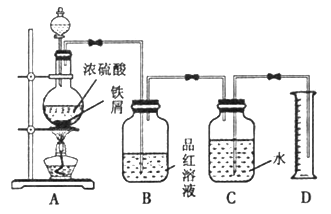
(1)组装好实验仪器后,接下来的实验操作是____________________;
(2)B中观察到品红溶液褪色,D中收集到VmL水,说明A中反应产生气体的成分
是______________________。
II.乙组同学对反应后圆底烧瓶溶液中所含金属离子进行探究。
(3)铁与浓H2SO4的反应过程中必有Fe3+生成。取适量反应后的溶液,加入少量KSCN溶液,不变红色。原因是_______________(用离子方程式表示)。
(4)取适量反应后的溶液,加人少量酸性高锰酸钾溶液,溶液褪色。该反应原理的离子方程式为 _______________________。
(5)取少量反应后的溶液,先滴加少量新制氯水,再滴加KSCN溶液,呈现血红色,继续滴加过量新制氯水,红色褪去。
①分析其可能的原因是:
A.溶液中Fe3+被氧化成更髙价;
B.____________________________;
C.______________________。
②请选用下列合适的化学试剂,验证结论A是否正确。0.lmol/L FeCl3溶液、lmol/L FeCl2溶液、KSCN溶液、新制氯水、一定浓度的H2O2溶液。
操作、现象及相关结论为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com