
科目: 来源: 题型:
【题目】有机物A 13.8g与0.95molO2恰好反应,生成标准状况下CO2 17.92 L,lmolA与足量碳酸氢钠溶液反应生成二氧化碳气体22.4L(标准状况)。D也能与碳酸氢钠溶液反应生成二氧化碳,经测定A的相对分子质量不大于200,各有机物的转化关系如图所示:
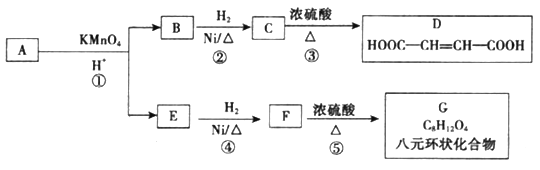
已知: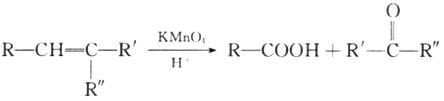
(l)A的分子式是________,E的结构简式为_________。
(2)写出反应类型,② :_________,⑤ __________。
(3)H与A互为同分异构体,写出符合下列条件的H的结构简式________。
① 属于芳香族化合物且苯环上有三个取代基
② 苯环上的一氯代物只有2种
③ lmolH与足量NaOH溶液反应最多可消耗2molNaOH。
(4)写出化合物G的结构简式:______________。
(5)写出由C生成D的化学方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B-少一个电子层。B原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大,D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 40%,且其核内质子数等于中子数,据此判断:
(1)D是_______。(填元素名称)
(2)B-的电子排布式____,A+的结构示意图____,D原子的轨道表示式______。
(3)在A、B、D三种元素的简单离子中,其离子还原性最强的是________。(填离子符号)
(4)用电子式表示化合物AB的形成过程________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上将Na2CO3和Na2S配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2。已知:
S (s)+Na2SO3(aq)![]() Na2S2O3(aq)。下列说法不正确的是
Na2S2O3(aq)。下列说法不正确的是
A. 上述反应中氧化剂和还原剂的物质的量比是2:l
B. 上述反应中的Na2CO3和Na2S的物质的量比最佳是1:2
C. 每生成lmol Na2S2O3转侈4mol电子
D. 通入的SO2过量很多,将会产生浑浊现象
查看答案和解析>>
科目: 来源: 题型:
【题目】化学方程式为3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A. 反应中MnO2是氧化剂 B. 该反应属于复分解反应
C. KClO3在反应中失去电子 D. 反应中每生成lmol K2MnO4,氧化剂得到2mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关如图所示的说法正确的是
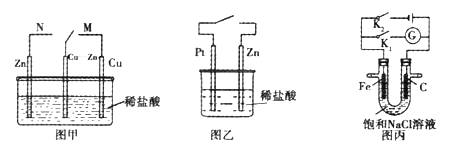
A. 图甲中开关置于N处时铜锌合金腐蚀的速率增大
B. 图乙中接通开关时,锌腐蚀的速率增大,锌上放出气体的速率增大
C. 图丙中接通K2时铁棒不被腐蚀,属于牺牲阳极保护法
D. 图丙中接通K1时,石墨棒周围溶液的pH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
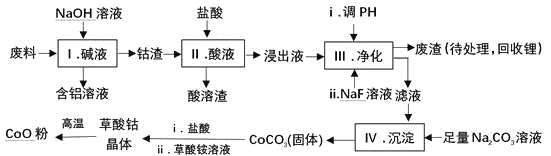
已知:①物质溶解性:LiF难溶于水,CoCO3难溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)Ⅰ中得到钴渣的实验操作是 (填操作名称)。
(3)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(4)步骤Ⅲ中调节溶液的pH时, pH的范围是 。
(5)废渣中的主要成分有 .
(6)在空气中加热10.98g草酸钴晶体(CoC2O42H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
温度范围/℃ | 固体质量/g |
150~210 | 8.82 |
290~320 | 4.82 |
890~920 | 4.5 |
②加热到210℃时,固体物质的化学式为: .
③经测定,加热到210~310℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为: ..
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”,工业上用钛矿石(主要成分:FeO、TiO2,SiO2等)为原料制取钛,工艺流程如下,回答下列问题:
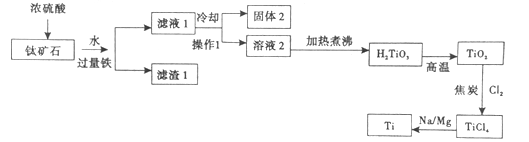
已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是__________。
(2)操作1名称为_______,固体2的主要成分是______, 写出金属钠与TiCl4共热的化学反应方程式_________________。
(3)一定温度下,在一个固定容积的容器中发生反应:TiO2(s)+2Cl2(g)+2C(s)![]() TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
TiCl4(g)+2CO(g),反应中氧化剂是________,下列说法能够说明该反应已达化学平衡状态的是_________________。
A.反应每断裂2个Cl一Cl键,同时生成2 个C![]() O键
O键
B. 容器内压强不再发生变化
C. Cl2和TiCl4的浓度不再变化
D.v(TiCl4)正=2v(C)逆
(4)将50吨钛矿石经上述变化后,最终可得金属钛12吨,假设各步反应均完全,则原矿石中TiO2的百分含量为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。
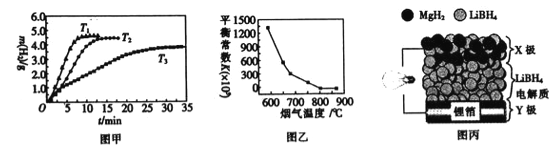
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com