
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式为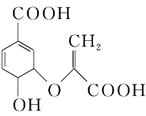 ,下列关于分枝酸的说法不正确的是
,下列关于分枝酸的说法不正确的是
A. 分子中含有3种含氧官能团
B. 1 mol分枝酸最多可与3mol NaOH发生中和反应
C. 在一定条件下可与乙醇、乙酸反应,且反应类型相同
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液退色,但退色原理不同
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS溶液的pH___7(填“>”“=”或“<”),理由是_________________________________。
(2)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式____________________________。
(2)已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
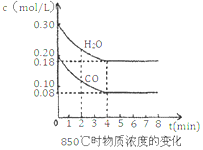
下列说法正确的是______________________(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.4min内CO2的反应速率为0.003 mol/(L·min)
D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2。若达平衡时各组分体积分数都与(2)中平衡时相同,则a=____________mol,b=________mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
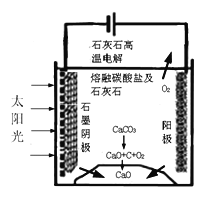
①上述生产过程的能量转化方式是_________________。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,则阴极的电极反应式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的下列性质能肯定该物质为离子化合物的是 ( )
A.水溶液能导电的化合物 B.由金属元素和非金属元素组成的化合物
C.在熔化状态下能导电的化合物 D.熔点高的物质
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
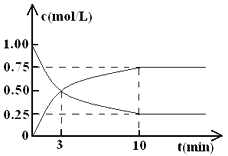
(1)从反应开始到平衡,氢气的平均反应速率v( H2 )= ________ ,CO2的转化率=________。
(2)该反应的平衡常数表达式k=__________ 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是_________________ (填编号)。
A.将H2O(g)从体系中分离B.充入He(g),使体系压强增大
C.升高温度 D.再充入lmolCO2和3molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO![]() 、SO
、SO![]() 、Na+
、Na+
B. 由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO![]()
C. c(H+)/c(OH-)=1012的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关焓变与反应热的说法,正确的是
A.反应热和焓变的单位都是kJ
B.如果反应是在恒温恒压条件下进行的,此时的反应热和焓变相等
C.如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等
D.任何化学反应的反应热均可通过实验直接测定
查看答案和解析>>
科目: 来源: 题型:
【题目】【选修3:物质结构与性质】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为_________,C、N、O三种元素的第一电离能由大到小的顺序为_________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2, 1 mol CN中含有的π键的数目为_________。与CN互为等电子体的分子有_______ (写出一种即可)。
(3)在络离子[Cu(NH3)4] 2+中 NH3 的 VSEPR 模型为____________,其中N原子的杂化轨道类型为_________。
(4)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________________。
(5)晶体是由无数晶胞___________而成。铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为______,若该晶胞的晶胞参数为d nm,则该合金的密度为______g/cm3 (不必化简,用NA表示阿伏加德罗常数)。

查看答案和解析>>
科目: 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间的关系如图所示,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是
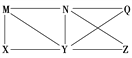
A. X可能为Al或Cl2 B. Y一定为NaOH(aq)
C. N一定是HCl(aq) D. Q、Z中的一种必为Al2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g) ![]() 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )

A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com