
科目: 来源: 题型:
【题目】填空:
(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑥INaOH固体⑨SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩液氯 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②与0.1 mol·L-1的NaHSO4溶液的导电能力相同的硫酸溶液的物质的量浓度为:_______________。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
④3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程式为________________________________________。
(3)等质量SO2和SO3的分子数之比为_____,同温同压下的密度之比为_____,含氧原子数之比为____。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:![]() (主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
(主要产物)1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
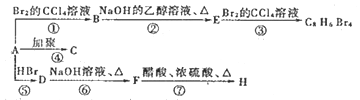
(1)A的化学名称___________,B的分子式为___________。
(2)上述反应中,②是_______反应 (填反应类型) 。
(3)写出E、H物质的结构简式E______,H ________。
(4)出D-F反应的化学方程式 ____________。
(5)写出A—C反应的化学方程式 __________。
(6)满足下列条件的H的同分异构体有________种。(除H外)
①苯环上只有一个支链。②与H宫能团相同且能够水解。
查看答案和解析>>
科目: 来源: 题型:
【题目】凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。
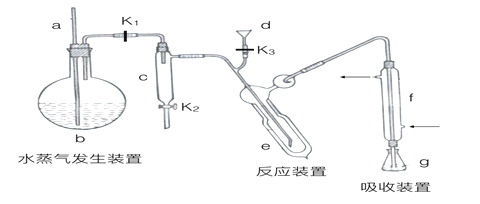
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是:
A. 在一个氧化还原反应中,氧化剂的氧化性强于氧化产物
B. 在一个氧化还原反应中,还原产物的还原性弱于还原剂
C. amolH2SO4中,含有b个氧原子,则阿伏加德罗常数可以表示为b/4a/mol
D. 配制0.05mol/LNa2CO3溶液90mL,需Na2CO3固体5.3g
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)SO2的催化氧化是硫酸工业的主要反应之一。现有标准状态下22.4LSO2气体,在500℃、V2O5催化下转化为SO3,若SO2的转化率为50%,放出热量为QKJ,则该反应的热化学方程式为____________.
(2)已知在SO2催化氧化前后混合气体中各成分的体积分数如图,则SO2的转化率为_______________。

(3)恒温、恒压下,在一个容积可变的密闭容器中发生:A(g)+ 2B(g)![]() C(g);开始加入3molA和5molB,体系体积为V升,平衡时可生成amolC,同样条件下,要使平衡时生成C为3.5amol,则开始时除加入5.5molB还需加入___________molA和_________molC。
C(g);开始加入3molA和5molB,体系体积为V升,平衡时可生成amolC,同样条件下,要使平衡时生成C为3.5amol,则开始时除加入5.5molB还需加入___________molA和_________molC。
查看答案和解析>>
科目: 来源: 题型:
【题目】在众多的新能源中,氢气将会成为21世纪最理想的能源。如图所示,硫酸工业中产生的S02通过下列过程既能制得H2O,又能制得H2。
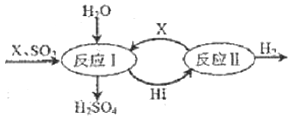
请回答:
(1)该过程中X 是_____________(写化学式)。
(2)写出该过程反应的化学方程式:I _________ ,II ______________ 。
(3)尾气中的S02可用NaOH溶液吸收,同时可得含Na2S03的样品,为测定样品中 Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
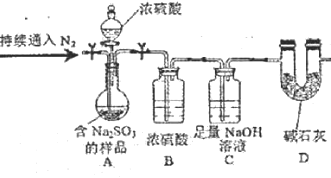
①A装置发生反应的化学方程式 __________。
②装置D的作用是 _______________ 。
③持续通入氮气的目的_______________ 。
④甜定样品中的质量分数所需的数据除含Na2SO3的样品质量外,还需要测 _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B. 镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C. 对于N2(g)+3H2(g)![]() 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
D. 电解NaCl或AlCl3制取Na或Al
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A元素的一种同位素,比镤91—239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A.第3周期第ⅠA族B.第4周期第ⅠA族
C.第5周期第ⅠA族D.第3周期第ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com