
科目: 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离
A. 苯和水 B. 食盐水和泥沙
C. 乙酸乙酯和乙酸 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目: 来源: 题型:
【题目】古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )
A. “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B. “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化
C. “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应
D. “火树银花”中的焰火实质上是金属元素的焰色反应
查看答案和解析>>
科目: 来源: 题型:
【题目】以下有关物质结构的描述正确的是
A. 甲苯分子中的所有原子可能共平面
B. 乙烷分子中的所有原子可能共平面
C. CH2=CH—C6H5分子中的所有原子可能共平面
D. 二氯甲烷分子为正四面体结构
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐。易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究:
I.亚硝酸钠的制备

(1)实验中用恒压滴液漏斗,相比于普通分液漏斗,其显著优点是___________。
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的化学反应方程式__________________。
Ⅱ.探究亚硝酸钠与硫酸反应气体产物的成分
已知:①NO+NO2+2OH-=2NO2-+2H2O ②气体液化的温度:NO2 为21℃、NO为 -152℃
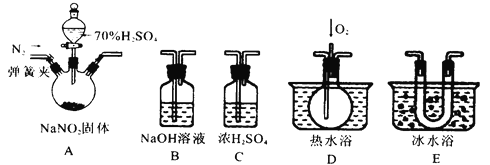
(3)反应前应打开弹簧夹,先通入一段时间的氮气,目的是___________________。
(4)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接)为A、C、_______、_______、_______。
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。
①确认A中产生气体含有NO,依据的现象是____________________________。
②装置E的作用是__________________________________________________。
(6)如果没有装置C,对实验结论造成的影响是________________________。
(7)通过上述实验探究过程,可得出装置A中反应的离子方程式是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:
①![]()
![]()
![]() ;
;
②![]()
![]()
![]() 。
。
下列说法正确的是( )
A. 两个反应中硫元素均被氧化
B. 碘元素在反应①中被还原,在反应②中被氧化
C. 氧化性: ![]()
D. 反应①②中生成等量的![]() 时,转移电子数之比为1:5
时,转移电子数之比为1:5
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得![]() :
:![]()
![]()
![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A. ![]() 在反应中是还原剂
在反应中是还原剂
B. ![]() 参加反应,在标准状况下能得到22.4L气体
参加反应,在标准状况下能得到22.4L气体
C. 在反应中![]() 既不是氧化剂也不是还原剂
既不是氧化剂也不是还原剂
D. ![]() 参加反应有
参加反应有![]() 电子转移
电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
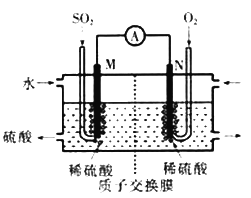
【题目】硫酸工业尾气中的SOj是常见的大气污染物,可通过以下几种方式变废为宝:
(1)电化学处理法:硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料)写出N极发生的电极反应式________________________;溶液中的阳离子向______极(M或N)移动,标准状况下,当有22.4LSO2参加反应时,溶液中有________mol阳离子向该极移动。
(2)钠碱循环法:用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1mol/L的Na2SO3溶液中,①当溶液的PH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c (SO32-)的浓度是0.2mol/L,则此时溶液中离子浓度由大到小的顺序为_______________。
②当溶液的PH降至约为6时,需送至电解槽再生,再生示意图如下:
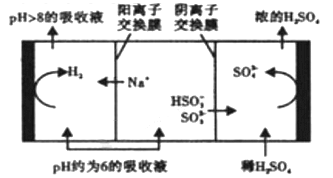
HSO3-在阳极放电的电极反应式是______________________________。
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】控制变量法是科学研究中的一种常用方法,下表中产生H2速率最快的是
编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
A | Al | 0.2 mol | 18.4mol/L H2SO4 | 10mL | 30℃ |
B | Mg | 0.2 mol | 3 mol/L H2SO4 | 20mL | 30℃ |
C | Fe | 0.1 mol | 3 mol/L H2SO4 | 20mL | 60℃ |
D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10mL | 60℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com