
科目: 来源: 题型:
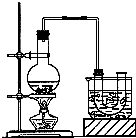 已知:CH3CH2OH+NaBr+H2SO4(浓)
已知:CH3CH2OH+NaBr+H2SO4(浓)| △ |
| △ |
| △ |
查看答案和解析>>
科目: 来源: 题型:
| 次数 | V(NaOH)/mL | V(HCl)/mL |
| 1 | 20.48 | 22.46 |
| 2 | 25.00 | 21.98 |
| 3 | 25.00 | 22.36 |
| 次数 | V(NaOH)/mL | V(HCl)/mL | ||||
| 始读数V1 | 终读数V2 | V2-V1 | 始读数V1′ | 终读数V2′ | V2′-V1′ | |
| 1 | 0.10 | 25.00 | 0.00 | 24.80 | ||
| 2 | 0.00 | 24.80 | 0.10 | 22.32 | ||
| 3 | 0.00 | 24.80 | 0.00 | 24.70 | ||
| △ |
查看答案和解析>>
科目: 来源: 题型:
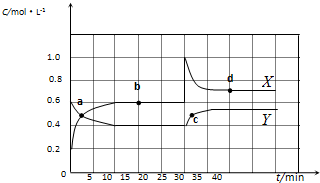 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示.| 10 |
| 9 |
| 10 |
| 9 |
查看答案和解析>>
科目: 来源: 题型:
 据测定指示剂酚酞的结构简式如图所示,则:
据测定指示剂酚酞的结构简式如图所示,则:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| H2S | H2S?H++HS- HS-?H++S2- |
Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
查看答案和解析>>
科目: 来源: 题型:
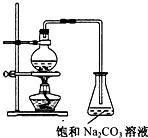 乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH
乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH| 浓H2SO4 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
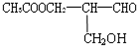 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性.如图有机物发生下列反应后的生成物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性.如图有机物发生下列反应后的生成物无光学活性的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com