
科目: 来源: 题型:
【题目】以下是实验室常用的部分仪器,请回答下列问题

(1)序号为⑩的仪器的名称为______________;
(2)能作反应容器且可直接加热的仪器是上述中的___________(填名称);
(3)仪器上标有温度的是_________(填序号);
(4)若用CCl4 提取碘水中的碘,必须用到上述仪器中的_________(填序号),试描述静置后的现象_____________________________________________;
(5)甲同学想用如下图装置,以大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。丙同学采用的方法是___________________________;
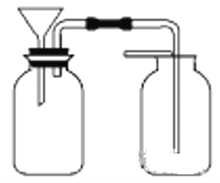
(6)乙同学也想制取CO2气体,而实验室只有H2SO4、浓HNO3、水、块状纯碱、块状石灰石,比较合理的方案应选用的药品是__________________________________;
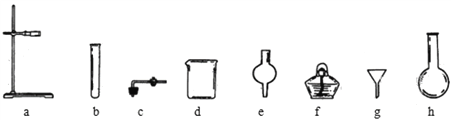
(7)丙同学在没有现成的CO2气体发生器的情况下,选用下图中的部分仪器,装配成一个简易的、能随用随停的CO2气体发生器,应选用的仪器是________(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: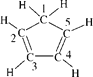 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
查看答案和解析>>
科目: 来源: 题型:
【题目】“一带路(OneBeltAndOneRoad)”构建人类命运共同体,符合国际社会的根本利益,彰显著人类社会的共同理想和关好追求。下列贸易的商品中,其主要成分属于无机物的是
A. 中国丝绸 B. 埃及长绒棉 C. 乌克兰葵花籽油 D. 捷克水晶
查看答案和解析>>
科目: 来源: 题型:
【题目】
尼龙是世界上出现的第一种合成纤维。尼龙的出现使纺织品的面貌焕然一新,它的合成是合成纤维工业的重大突破,同时也是高分子化学的一个重要里程碑。下图是以1,3—丁二烯为原料来合成尼龙66的路线:
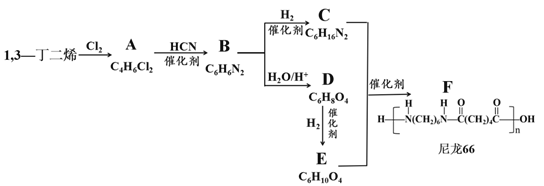
已知:
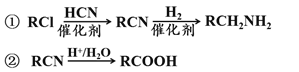
③A存在顺反异构
根据以上信息回答下列问题:
(1)下列关于有机高分子化合物的说法正确的是________。
A.有机高分子化合物均可水解为小分子
B.淀粉和纤维素的分子式均为(C6H10O5)n,它们互为同分异构体
C.蛋白质的盐析过程是物理变化
D.因蛋白质在高温下易变性,所以疫苗保存时需冷藏
(2)有机物A的结构简式为_______________,A→B的反应类型为___________。
(3)D中所含官能团的名称为_______________________。
(4)写出C+E→F的化学方程式______________。
(5)与E官能团相同的同分异构体有______种(不包括E),写出其中核磁共振氢谱有4组吸收峰且峰面积之比为2:4:1:3的结构简式________________。
(6)已知:
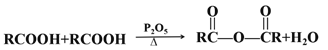
以CH2=CH2为原料,其他无机试剂任选合成 
结合本题信息写出合成路线_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】COS 、H2S是许多煤化工产品的原料气。已知
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H=X kJ·mol-1;
H2S(g)+CO(g) △H=X kJ·mol-1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-42 kJ·mol-1;
CO2(g)+H2(g) △H =-42 kJ·mol-1;
(1)断裂1 mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1319 | 442 | 1076 | 678 | 930 | 1606 |
X=___________。
(2)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应,在T10C时达到平衡,体系内CO的体积分数为5%(如下图M点)。

请回答下列问题:
①请在图中画出以M为起点,从T1℃开始升温过程中CO的平衡体积分数随温度变化的曲线。_____
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol,则平衡时H2O的转化率为_________。
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M中充入1 mol CO和1 mol H2O,在N中充入1 mol CO2和1 mol H2,均在700 ℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_______。
A.容器M、N中正反应速率相同
B.容器M中CO的物质的量比容器N中的多
C.容器M、N中反应的平衡常数相同
D.容器M中CO的转化率与容器N中CO2的转化率之和小于1
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
______________________________________;常温下,用100mL 0.1mol·L-1NaOH溶液吸收224mL(标况)H2S气体,反应后离子浓度从大到小顺序为_____________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示:

①25℃时Ksp(CuS)=__________________。
②25℃时向50.0mL Sn2+、Cu2+浓度均为0.01mol·L-1的混合溶液中逐滴加入Na2S溶液到50.0mL时开始生成SnS沉淀,此时溶液中Cu2+浓度为__________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. NH3极易溶于水,可用于工业制冷剂
B. HNO3具有酸性,可用于制备硝酸盐原料
C. NH4 NO3易溶于水,可用于制造高温材料
D. N2难溶于水,可用于合成氨原料
查看答案和解析>>
科目: 来源: 题型:
【题目】
人类社会的发展与进步与材料的发展密不可分,而金属是人类常用的一类材料如铜、铁合金等等。
(1)基态Cu原子的价电子排布式为__________,在元素周期表中的位置为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到。乙醛中碳原子的杂化方式有______________,乙醛分子中![]() 键与
键与![]() 键的数目之比为____________。
键的数目之比为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。铜、碳、硼、氮元素的电负性由大到小的顺序是_________________。(用元素符号表示)
(4)Cu(OH)2溶于氨水形成深蓝色的[Cu(NH3)4]2+,该配合物中NH3的价层电子对互斥模型为_____________。
(5)铁在不同温度范围有不同的晶体结构,在室温下为体心立方,当温度升高到912℃,则转变为面心立方。铁的体心立方堆积和面心立方最密堆积的配位数分别为____、_____。若铁原子半径为r pm,则铁为面心立方最密堆积时的晶体密度为___________g/cm3(阿伏伽德罗常数的值用NA 表示,1pm=10-12m,写出计算式即可)。
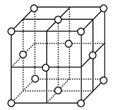
面心立方晶胞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com