
科目: 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是( )
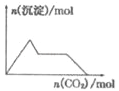
A. 含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2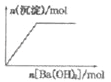
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液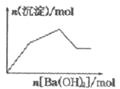
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液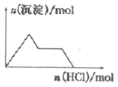
D. NaAlO2溶液中逐滴加入盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:__________________,E元素位于元素周期表__________________。
(2)A、B、C三种元素的第一电离能最大的是_________(用元素符号表示)。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________________________ (写化学式)。
(3)D可形成化合物[D(H2O)6](NO3)3 。①[D(H2O)6](NO3)3中配位体的VSEPR模型名称是__________________。该化合物中阴离子的中心原子的轨道杂化类型为_________。
②1 个 [D(H2O)6]3+ 中含有的σ键数目为_________个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子,另一种化合物的电子式为_________。
(5)E+离子能与SCN-离子形成ESCN沉淀。SCN-离子对应的酸有硫氰酸(H―S―C≡N)和异硫氰酸(H―N=C=S),这两种酸沸点更高的是______________(填名称),原因是________________________。
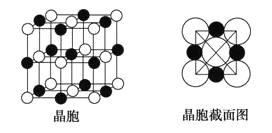
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个A+最近的A+有_______个,距离一个A+最近的C-围成的图形是______________(写名称)。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的半径为_________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]() ①
①
![]() ②
②
![]() ③
③
![]() ④
④
请回答下列问题
(1)这四个反应中属于氧化还原反应的有 ___________个。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物和还原产物依次是 ____、____。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为 _____ 。
(5)反应②中所得混合气体的平均摩尔质量是 ____________ 。(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
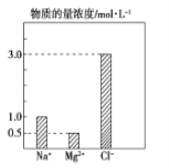
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-。为了进一步确认,对该溶液进行实验检测:
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无________。 | 肯定无该离子的理由______________。 |
步骤二 | 该溶液呈无色、透明、均一状态; | 肯定无________。 | 肯定无该离子的理由______________。 |
(1)实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、 _________、干燥、在干燥器中冷却。
(2)原溶液中H+物质的量浓度为 __________mol/L。
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为:____________________________。
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,当Mg2+恰好沉淀完全时加入的Ba(OH)2溶液体积为_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 碱金属随原子序数的增大,其熔沸点逐渐降低
B. 卤素单质随原子序数的增大,其氧化性逐渐增强
C. 在周期表中,族序数都等于该族元素的最外层电子数
D. 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号
![]()
①相连的两种物质都是电解质的是________________(填分类标准代号,下同)都是氧化物的是__________________
②图中相连的两种物质能够相互反应的是_________________________,所属基本反应类型的是______________________反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为_______________________________________________________
④用洁净的烧杯取25 ml 蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________________,证明该分散系生成的实验原理是_________________________________________。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中使用分类的方法处理问题,可以做到举一反三,还可以做到由此及彼。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H20,可完成SO3与NaOH反应的离子方程为______________________________________。
②NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,NaHCO3+HCl==NaCl+H20+CO2↑及NaHCO3+NaOH==Na2CO3+H20,可完成NaHS分别与HCl、NaOH反应的离子方程式为________________________________、________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g) =2NO2(g) ΔH = +133 kJ·mol-1
H2O(g) = H2O(l) ΔH =-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:__________________________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均摩尔质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。________________________

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”、“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH) =______________ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”)______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com