
科目: 来源: 题型:
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
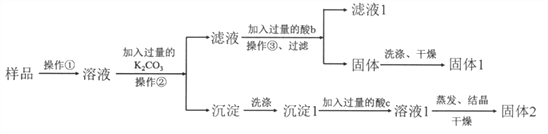
(1)加入过量K2CO3所发生反应的离子方程式为_________________________________;
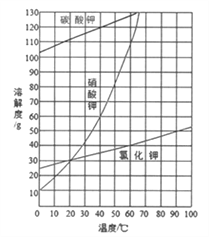
(2)结合下图各物质的溶解度曲线可知操作③的名称是_________________;
(3)有人认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该观点是否正确?并做出解释______________________________________。
(4)用制得的 KNO3固体配制 200 mL0.2mol/L KNO3 溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有_______________;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是______________(填字母)。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线 D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】
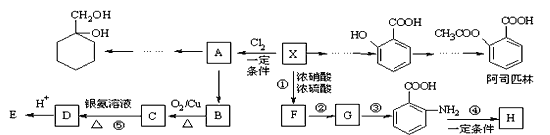
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:
Ⅰ. ![]()
Ⅱ. ![]() (苯胺、易被氧化)
(苯胺、易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是__________;C的名称是___________。
(2)H的结构简式是_____________。
(3)反应②、④的类型是__________。
(4)反应⑤的化学方程式是____________;
(5)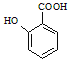 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有_______种。
(6)请用合成反应流程图表示出由A和其他无机物(溶剂任选)合成 最合理的方案。
最合理的方案。
示例如下:

____________
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种重要的试剂,有着广泛的用途,工业上可利用CO2制备甲醇。
(1) 间接法:用CH4与CO2反应制H2和CO,再利用H2和CO化合制甲醇。
已知:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1450.0KJ/mol
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0KJ/mol
③ 2H2(g)+O2(g)=2H2O(l) △H3=-571.6KJ/mol
则H2和CO制液态甲醇的热化学方程式为_________。
(2)直接法: H2和CO2在特定条件下制甲醇的反应为:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)。在某固定体积的密闭容器中充入一定量的H2和CO2,在催化剂、一定温度作用下(前30分钟内温度为T0 ℃),测得反应物浓度与时间的关系如下图所示。
CH3OH(g)+H2O(g)。在某固定体积的密闭容器中充入一定量的H2和CO2,在催化剂、一定温度作用下(前30分钟内温度为T0 ℃),测得反应物浓度与时间的关系如下图所示。
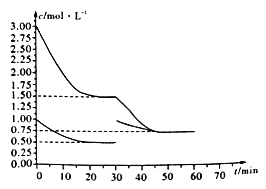
回答下列问题:
①该反应的化学平衡常数表达式K=_________;在T0℃反应达到平衡时,甲醇的体积分数为_________。(保留三位有效数字)
②保持温度和体积不变,下列情况可说明反应一定达到平衡状态的是_______。(填字母代号)
a.混合气体密度不变
b.反应体系压强不变
c.H2和 CO2的浓度之比为3:1
d.每断裂3mol的H-H键同时断裂3molC-H键
③其他条件不变,温度调至T1℃ (T1>T0),当反应达到平衡时测得平衡常数为K1(K10),则该反应为_____________(填“吸热反应”、“放热反应”)。
④在30分钟时,通过改变CO2的浓度(由0.5mol/L增至1.0mol/L),根据图示变化,通过计算说明只改变该条件能否建立45分钟时的平衡状态(K2)___________。(相关结果保留三位有效数字)
(3)甲醇可作燃料电池的原料,若电解质溶液为盐酸,当外电路转移12mol电子时(不考虑电子损失),将负极所产生的气体全部通入到2L 1.5mol/L的NaOH溶液中,充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【加试题】常温下碘酸钙[Ca(IO3)2]是一种白色晶体,微溶于水,不溶于乙醇,能溶于盐酸,是目前广泛使用的既能补碘又能补钙的新型食品和词料添加剂。其制备原理如下:
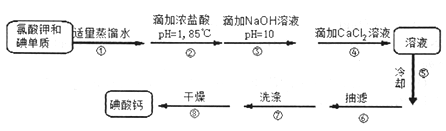
Ⅰ.碘酸钙的制备
(1)某同学设计的实验装置如下图所示(夹持装置已省略),步骤②的加热方式为_________。
(2)步骤⑤冷却热的饱和溶液没有析出晶体,为了得到晶体可以采取的一种措施是________。
(3)步骤⑦洗涤的具体操作是____________。
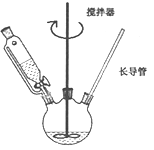
Ⅱ.产品纯度测定
准确称取0.5000 g样品,酸化溶解,定容至250 mL,从中取出25.00 mL试样于锥形瓶中,加入足量的KI充分反应,用0.04000 mol·L-1硫代硫酸钠溶液滴定至终点,重复以上步骤,所测得实验数据如下:
1 | 2 | 3 | |
滴定起始读数/mL | 1.52 | 1.16 | 0.84 |
滴定终止读数/mL | 31.50 | 31.18 | 30.84 |
己知:2Na2S2O3 + I2= Na2S4O6 + 2NaI
(4)加入KI时发生反应的离子方程式是_____________。
(5)滴定时所用的指示剂是_________________.
(6)经计算产品的纯度为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知X、Y在生成物中化合价均为+2价)。则下列说法中不正确的是
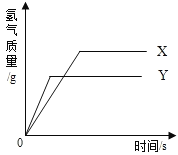
A. 生成氢气的质量:X﹥Y B. 相对原子质量:X﹥Y
C. 金属活动性:Y﹥X D. 消耗硫酸的质量:X﹥Y
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素在地壳中含量丰富,下列有关说法正确的是( )
A.铁合金是我国使用最早的合金
B.可用铁制品盛放冷的浓硫酸
C.向某溶液中加入KSCN,溶液变为血红色,说明该溶液中含有Fe2+
D.Fe(OH)3不能通过化合反应制得
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式_______________;
(3)下列与胶体性质无关的是_____________(填字母);
A.河流入海口处形成沙洲
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
E.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________;
(5)向氢氧化铁胶体中逐滴加入稀硫酸至过量的现象是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 元素周期表中的主族都有非金属元素
B. 元素周期表中的主族都有金属元素
C. 元素周期表中的非金属元素都位于短周期
D. 除稀有气体元素外,元素周期表中的非金属元素都属于主族元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com