
科目: 来源: 题型:
【题目】氮的固定对工农业及人类生存具有重大意义。
合成氨是最重要的人工固氮:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)下列关于该反应的说法中,正确的是___________(填正确选项字母编号)。
A.反应达到平衡状态时,N2、H2、NH3的体积比为1∶3∶2
B.加催化剂可以加快正反应速率,减慢逆反应速率
C.高温既有利于加快反应速率也有利于提高氨气的产率
D.高压既有利于加快反应速率也有利于提高氨气的产率
(2)一定温度下,在容积为1L的密闭容器中,加入lmolN2和3mol H2,反应达到平衡时H2的转化率为60%,此时反应消耗N2物质的量为___________mol;保持容器体积不变,再向容器中加入1molN2,3mol H2,反应再次达到平衡时,氢气的转化率将___________(填“增大”或“减小”或“不变”)。
(3)标准状况下,将22.4 mL的氨气通入100 mL 0.01 mol·L-1的盐酸中,充分反应后,溶液中各离子浓度由大到小的顺序是________________________。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学反应方程式为____________________。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递 H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如图所示,写出阴极的电极反应式____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g) K3 ③
H2O(g)+CO(g) K3 ③
又知不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500℃时进行反应①,CO2起始浓度为2 mol·L1,2 min后建立平衡,则CO2转化率为_________,用CO表示的化学反应速率为____________。
(2)900℃时进行反应③,其平衡常数K3为___________(填具体数值),焓变ΔH_____0(填“>”“=”或“<”),若已知该反应仅在高温时正反应自发进行,则ΔS_____0(填“>”“=”或“<”)。
(3)下列图像符合反应②的是____________(填序号)。(图中v是速率,φ为混合物中H2的体积百分含量。)
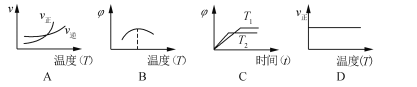
查看答案和解析>>
科目: 来源: 题型:
【题目】在带有活塞的密闭容器中发生反应:Fe2O3+3H2=2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A. 增加Fe2O3的量 B. 保持容器体积不变,增加H2输入量
C. 减少Fe的量 D. 保持容器体积不变,增加H2O(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度,相同物质的量浓度的4种溶液( )
①CH3COONa ②NaHSO4 ③NaCl ④Na2CO3
按pH由大到小的顺序排列,正确的是
A.④>①>③>②B.①>④>③>②
C.①>②>③>④D.④>③>①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】随着工业的发展,大气中CO2的浓度不断增加,如何减少CO2排放已成为全世界关注的热点,低碳经济和低碳生活成为热门话题,以下做法与低碳要求相违背的是 ( )
A.控制高能耗企业上马 B.尽量不使用一次性筷子
C.提倡骑自行车、乘共交车出行 D.多挖煤,多发电,加快经济发展
查看答案和解析>>
科目: 来源: 题型:
【题目】“一带一路“贸易使国外的特色产品走进百姓日常生话,下列商品的主要成分不属于天然高分子的是( )
A. 马来西亚橡胶树产橡胶 B. 德国产不锈钢制品
C. 泰国产羽绒服中的羽绒 D. 埃及产粗亚麻地毯
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________。
(3)若pH过高,则对产品的影响是________________________。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
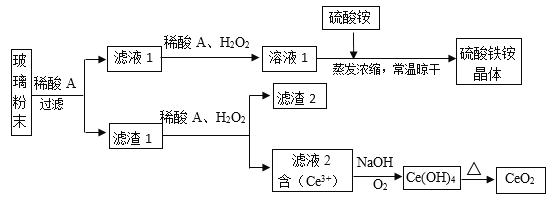
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 周期表中0族元素的单质常温常压下均为气体
B. 周期表中含元素种类最多的族为Ⅷ族
C. 所有主族元素均在短周期中
D. 第n周期n主族的元素均为非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com