
科目: 来源: 题型:
【题目】(1)钾云母的化学式为K2H4Al6Si6O24,其简单氧化物表示形式为_____________。
(2)长石的化学式为KAlSi3Ox,x=____。
(3)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_________。
(4)向明矾水溶液中滴加过量氨水,现象是__________________________,反应的离子方程式______________________________________________,再向其中加入过量NaOH溶液,反应的化学方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·5H2O),方案如下:

金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________L。
(2)加入H2O2的目的是____________。
(3)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为____________。
a.Cu(OH)2 b.H2SO4 c.NH3·H2O d.Na2CO3
(4)滤液D中加入硫酸的目的为_______________________________________。
(5)从溶液E制得CuSO4·5H2O晶体所需要的步骤为________、结晶、过滤和干燥。
(6)0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。试确定200℃时固体物质的化学式______________。
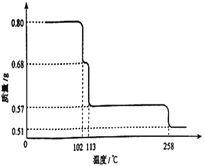
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是
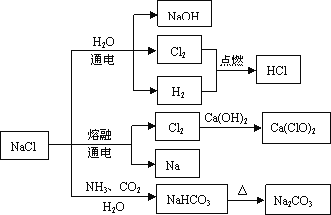
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)ΔH=1269kJ/mol
2N2(g)+6H2O(g)ΔH=1269kJ/mol
②
下列说正确的是
A.断开1 mol O=O键比断开1 mol N≡N键所需能量多448 kJ
B.断开1 mol H―O键比断开1 mol H―N键所需能量相差约72.6 kJ
C.由以上键能的信息可知H2O的沸点比NH3高
D.由元素非金属性的强弱可知 H―O键比H―N键弱
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠广泛用于电镀、金的提取及有机合成中,含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3。说明酸性:HCN___(填“>”或“<”)H2CO3。
(2)含CN-浓度较低的废水可直接用FeSO4 7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为324 g mol-1,则M的化学式为_______。
(3)pH在7.510之间用铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1:1,则该反应的离子方程式为___________。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下:
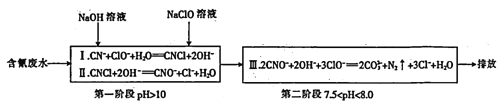
①第一阶段的中间体CNC1中碳元素的化合价为________。
②某工厂含氰废水中NaCN的含量为147 mg L-1,处理10m3这样的废水,理论上需要5 mol L-1的NaClO 溶液_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,跟100mL 0.6mol/L NaCl溶液所含的Cl-物质的量浓度相同的是(以下混合溶液的总体积近似看作各溶液体积之和) ( )
A. 50mL 0.6mol/L MgCl2溶液
B. 200mL 0.3mol/L AlCl3溶液与100mL 0.2mol/L AgNO3溶液的的混合溶液
C. 70ml 1mol/L NaCl溶液与100ml 1mol/L KCl溶液的混合溶液
D. 25ml 0.6mol/L HCl溶液 与50mL 0.3mol/L MgCl2溶液的混合溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】从海带中提取碘,有甲、乙两种实验方案如下:
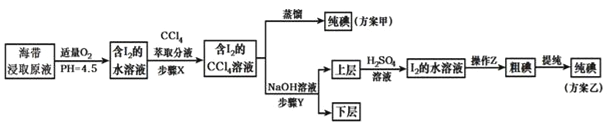
已知:3I2+6NaOH═5NaI+NaIO3+3H2O.请回答:
(1)步骤 X 的操作为萃取分液,分液时需用到分液漏斗,分液漏斗在使用前需_____.
(2)方案甲进行蒸馏操作时,通常使用水浴加热,其优点是_____.
(3)方案乙在上层溶液中加入 H2SO4溶液得到 I2的水溶液,发生反应的化学方程式是_____
(4)操作 Z 的名称是_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、为三种常见的单质,其中A、C为气体,B为常见金属.A溶于水可使石蕊试液先变红后褪色.F的水溶液为浅绿色溶液,它们的关系如图1: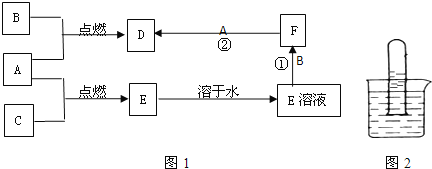
(1)写出A、B、D的化学式:A.____________B.____________D.____________
(2)写出反应①②的离子方程式:①____________;②____________.
(3)A溶于水使石蕊试液先变红后褪色的原因是:____________.
(4)检验D的水溶液中的阳离子的方法是(指出药品、试剂、步骤和现象):_____.将D溶液逐滴加入的沸水中会产生一种红褐色的液体.你认为该液体中的分散质粒子直径在____________之间,验证的简单方法是:____________。
(5)某同学将A的饱和溶液装满大试管倒置在烧杯中如图2,光照一段时间后,发现试管底部有无色的气体产生,溶液的颜色也变成无色,请你帮他对产生的气体进行探究:
①你预测气体可能是____________ 。
②针对你的预测写出验证实验方案(步骤和现象):___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com