
科目: 来源: 题型:
【题目】某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。
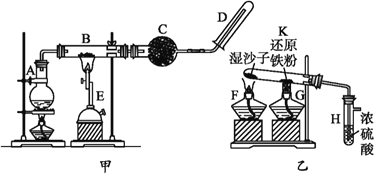
已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G 为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?________________。
(2)乙装置中湿沙子的作用是________________。
(3)B处发生反应的化学方程式为_________________。
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是________________。
(5)对比甲、乙两装置的B和K,B的优点是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如下图所示。肼能与双氧水发生反应:N2H4+ 2H2O2=== N2+ 4H2O。下列说法正确的是()
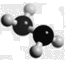
A. 标准状况下,3.2 g N2H4的体积是2.24L
B. 标准状况下,11.2 L N2中含电子总数约为7×6.02×1023
C. 标准状况下,22.4 L H2O2中所含原子总数约为4×6.02×1023
D. 若生成3.6 g H2O,则上述反应转移电子的数目约为2×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学欲探究NH3的还原性实验,按下图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2

(1)NH3催化氧化的化学方程式是__________。
(2)装置B中产生气体的原因有(结合化学用语解释)__________。
(3)甲乙两同学分别按上述装置进行实验。一段时间后,装置G中溶液都变成蓝色。
甲观察到装置F中有红棕色气体,乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)__________。用离子方程式解释装置G中溶液变成蓝色的原因:_________。
(4)该小组还利用下图所示装置探究NH3能否被NO2氧化(K1、K2为止水夹,夹持固定装置略去).
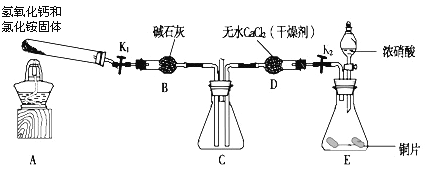
A中发生反应的化学方程式为________________________。
若NH3能被NO2氧化全部生成无毒物质,预期观察到C装置中的现象是___________。若此反应转移电子0.4mol,则消耗标准状况下的NO2_________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________
(5)丁组同学利用下列各图方案制备Fe(OH)2能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。


(6)戊组同学为了检验硫酸铁中含有的Fe2+应选用________(选填序号)并写出离子方程式______________
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的俗称、成分及用途对应正确的是( )
A | B | C | D | |
俗称 | 漂粉精 | 小苏打 | 钡餐 | 铁红 |
成分 | NaClO | Na2CO3 | BaCO3 | Fe2O3 |
用途 | 消毒剂 | 发酵粉 | X光片 | 涂料 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中要配制2mol/L的NaCl溶液980 ml,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是
A. 980 ml ,114.7g B. 500ml, 58.5g
C.1000 ml, 117 g D.1000ml, 117.0g
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示。
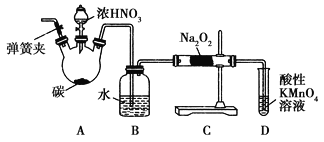
已知:室温下,①2NO+Na2O2===2NaNO2;②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体X,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。则X为_______,B中观察到的主要现象是__________________。
(2)A装置中反应的化学方程式为__________________。
(3)D装置中反应的离子方程式为__________________。
(4)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(5)亚硝酸钠对应酸为亚硝酸,下列事实中不能比较氢硫酸与亚硝酸的酸性强弱的是_________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硝酸可以
B.氢硫酸的导电能力低于相同浓度的亚硝酸
C.0.10 mol·L1的氢硫酸和亚硝酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol 化学键所需的能量(kJ):N≡N为942、O=O为500、N―N 为154,则断裂1 mol N―H 键所需的能量(kJ)是
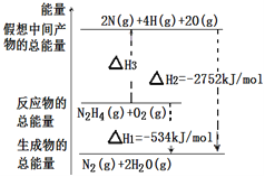
A.194 B.391 C.516 D.658
查看答案和解析>>
科目: 来源: 题型:
【题目】胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解;
②能溶于水;
③遇酸及酸性药物则产生二氧化碳;
④胃酸患者过多服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是________(填化学式);乙中含有的主要化学成分是________(填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____________________________。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com