
科目: 来源: 题型:
2- 4 |

查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:阅读理解
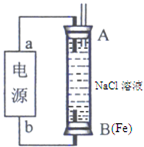 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目: 来源: 题型:
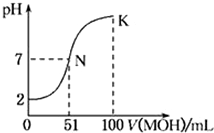 (2013?济南一模)常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02 mol?L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中,不正确的是( )
(2013?济南一模)常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02 mol?L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中,不正确的是( )查看答案和解析>>
科目: 来源: 题型:
(2013?济南一模)下列实验操作及现象能够达到对应实验目的是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com