
科目: 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A. 0.1(b-2a)mol·L-1 B. 10(2a-b) mol·L-1
C. 10(b-2a) mol·L-1 D. 10(b-a) mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学变化的是( )
①金刚石变成石墨 ②NaCl熔化
③HCl溶于水电离出H+和Cl- ④电解熔融的Al2O3制取A1
A. 只有④ B. ①④ C. ②③ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
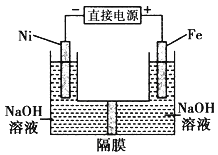
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种很有前途的能源物质,以水为原料制取大量氢气的最理想的途径是( )
A. 用活泼金属跟HCl反应放出H2 B. 以焦炭和水制取水煤气后分离出氢气
C. 由火力发电站提供电力电解水产生氢气 D. 利用太阳能直接使水分解产生氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验误差分析中,不正确的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有
①![]()
②![]()
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中加入等质量的水后,所得溶液的物质的量浓度大于0.5C
A. ②③ B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】实验题:如图是某硫酸试剂瓶标签上的内容。

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
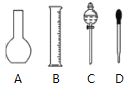
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。
(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。
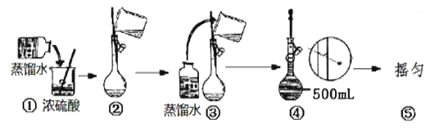
(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏低的是_____。
A.未经冷却趁热将溶液注入容量瓶中
B.容量瓶洗涤后,未经干燥处理
C.定容时仰视观察液面
D.摇匀后发现液面低于刻度线继续加水定容
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有Ba2+ 、Mg2+ 、Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
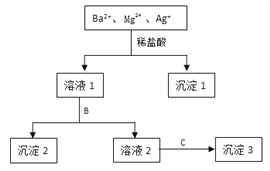
(1)沉淀1的化学式为__________,生成该沉淀的离子方程式为_______________。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为_______________。取溶液2反应前,怎样检验SO42-已除去_______________。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为_______________。
(4)如果原溶液中Ba2+ 、Mg2+ 、Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com