
科目: 来源: 题型:
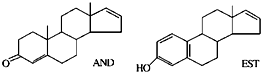 最近《美国科学院院刊》发表了关于人体体香的研究文章,文章称人的体味中存在两种名为“AND”和“EST”的荷尔蒙.关于“AND”和“EST”的下列说法中正确的是( )
最近《美国科学院院刊》发表了关于人体体香的研究文章,文章称人的体味中存在两种名为“AND”和“EST”的荷尔蒙.关于“AND”和“EST”的下列说法中正确的是( )查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
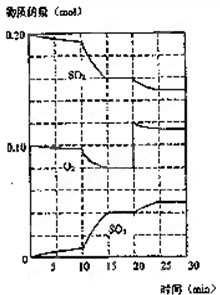 (2004?上海)在一定条件下,二氧化硫和氧气发生如下反应:
(2004?上海)在一定条件下,二氧化硫和氧气发生如下反应:| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
查看答案和解析>>
科目: 来源: 题型:
 I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com