
科目: 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为__________________。
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=﹣196.6 kJ·mol-1
2SO3(g) ΔH=﹣196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=﹣113.0 kJ·mol-1
2NO2(g) ΔH=﹣113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于一恒容密闭绝热容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJ·mol-1。
CH3OH(g) ΔH=﹣a kJ·mol-1。
在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为_____,正反应放出的热量为__________________。
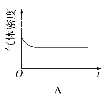
(4)已知N2O4(g) ![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。


查看答案和解析>>
科目: 来源: 题型:
【题目】CsIBr2是一种碱金属元素的多卤化物,有关该物质的说法正确的是( )
A. Cs显+3价,I、Br均显﹣1价
B. Cs显+1价,Br显+1价,I显﹣1价
C. CsIBr2具有较强的氧化性
D. CsIBr2不能与氯水反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铷的叙述中正确的是( )
A. 氢氧化铷是强碱
B. 在钠、钾、铷三种单质中,铷的熔点最高
C. 硝酸铷是共价化合物
D. 它位于周期表的第四周期、第ⅠA族
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2mol水的摩尔质量和1mol水的摩尔质量
B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-)
C.64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法中正确的是( )
①同温、同压下,相同体积的氟气和氩气所含的原子数相等
②标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
③在标准状况下,22.4L H2O的物质的量为1mol
④4℃时5.4mL的水所含的原子总数为0.9NA
⑤0.1molOH﹣含0.1NA个电子.
A.①②③
B.②④
C.①③④⑤
D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:
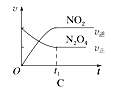
现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:

(1)若t1 = 10min,则0至t1时间内H2物质的反应速率为_______________________;
(2)下列说法中,可以证明反应N2(g)+3H2(g) ![]() 2NH3(g)已达到平衡状态的是__________。
2NH3(g)已达到平衡状态的是__________。
①单位时间内生成n molN2的同时生成2n molNH3
②1个N≡N键断裂的同时,有3个H—H键形成
③1个N≡N键断裂的同时,有6个N—H键形成
④混合气体的压强不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是________(填下列各项序号)
a.加入了催化剂 b.降低了反应的温度 c.向容器中又充入了气体N2
(4)平衡时N2的转化率为____________,容器内总压强是反应前的__________倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是(双选)( )
A.牛油是纯净物,它不属于高分子
B.牛油是高级脂肪酸的高级醇酯
C.牛油可以在碱性条件下加热水解
D.工业上将牛油加氢制造硬化油
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物的一氯代物的数目大小排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3②(CH3)2CHCH(CH3)2③(CH3)3CCH2CH3④(CH3)3CC(CH3)3
A. ①>②>③>④ B. ③=①>②>④ C. ③>②>④>① D. ②>③=①>④
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
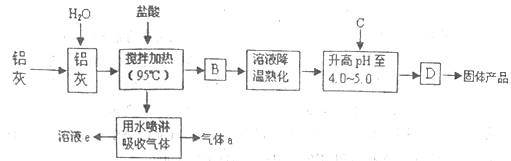
(1)反应中副产品a是______(用化学式表示);
(2)升高pH至4.0~4.5的目的是______;
(3)生产过程中可循环使用的物质是______(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用______(填编号);
a.NaOHb.Alc.氨水d.A12O3e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[A12(OH)nCl6-nH2O]m,实验室为测定n的值,进行如下操作:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg。此过程可能用到的下列仪器有______;
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取ag晶体:用A试剂溶解→加足量AgNO3溶液→进行C操作→洗涤、烘干→称量为cg。则试剂A为______(填操作名称),C操作为______(填操作名称)。最后综合推算出n的值_____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com