
科目: 来源: 题型:
【题目】下列说法中错误的是
A. 离子化合物中可能含有共价键
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 稀有气体元素原子的最外层都有8个电子
D. 元素周期表中金属元素和非金属元素分界线附近的元素可能用于制半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________, Z的电子式为_____________________。
II. KmnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________。此过程不用瓷坩埚的原因是_________________________。
(4)髙锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42- ),写出检验Mn2+的离子方程式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A,B丽种烃,已知A的分子式为C5Hm , 而B的最简式为C5Hn(m、n均为正整数).请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是(填序号).
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都在同一条直线上,则A的结构简式为 .
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A最多可与1mol H2加成,则A的名称是 .
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为;若其苯环上的一溴代物只有一种,则符合此条件的烃B有种.
查看答案和解析>>
科目: 来源: 题型:
【题目】由葡萄糖发酵可得乳酸,为研究乳酸的分子组成和结构,进行了下述实验:
(1)称取乳酸0.90g,在某种状况下使其完全气化,相同状况下同体积的H2的质量为0.02g,则乳酸的相对分子质量为 .
(2)若将上述乳酸蒸气在氧气中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰的质量增加1.86g;若将此产物通入过量石灰水中,则产生3.00g白色沉淀.则乳酸的分子式为 .
(3)另取0.90g乳酸,若与足量金属钠反应,生成H2224mL(标准状况),若与足量碳酸氢钠反应,生成224mLCO2(标准状况),则乳酸的结构简式可能为或 .
(4)若葡萄糖发酵只生成乳酸,其反应的化学方程式为 .
(5)乳酸与乙酸、乳酸与乙醇均能发生酯化反应,相同质量乳酸所生成的两种酯化产物(有机物)的质量比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(1)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和______________,写出生成MnO2的离子方程式___________________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_________________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为____________________。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______________。(填离子符号)
(7)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
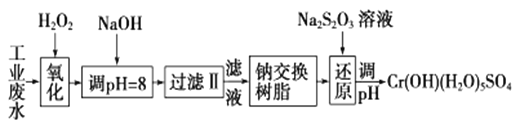
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。
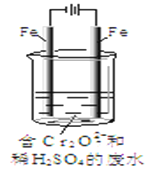
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)海水淡化后,为检验所得的淡水中是否含有氯离子,通常采用的试剂是
A. AgNO3溶液 B. AgNO3溶液和稀盐酸
C. AgNO3溶液和稀硝酸 D. 以上试剂均可
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 原电池是把电能转化为化学能的装置 B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 元素周期表中第ⅠA族全部是金属元素 D. 原电池中的阳离子向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com