
科目: 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命.表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(gmol﹣1) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾 | 0.84 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)配制1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、托盘天平、、 . (在横线上填写所缺仪器的名称).
(2)在溶液配制过程中,卜^列操作对配制结果没有影响的是 .
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)一鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是
A. 与液溴混合后加入铁粉可发生取代反应
B. 能使酸性高锰酸钾溶液褪色
C. 1 mol苯乙烯最多能消耗2.5 molH2
D. 在催化剂存在下可以制得聚苯乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
根据反应中观察到的现象,回答下列问题: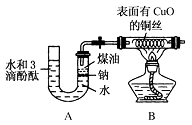
(1)反应过程中金属钠除了逐渐变小外,还有什么现象? . 请写出该反应的化学方程式为 .
(2)铜丝的变化现象 , 反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解池的说法正确的是
A.电源的负极就是阴极
B.阳极上发生还原反应
C.与直流电源正极相连的电极是电解池的阳极
D.与直流电源负极相连的电极上发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是 ( )
A. H2(气)+I2(气) ![]() 2HI(气)
2HI(气)
B. 3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C. 2SO2(气)+O2(气) ![]() 2SO3(气)
2SO3(气)
D. C(固)+CO2(气) ![]() 2CO(气)
2CO(气)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )

①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是
A.右图表示反应①中的能量变化
B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目: 来源: 题型:
【题目】锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝与软锰矿反应剧烈,所以先在强热条件下将软锰矿转变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为____________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(E)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。
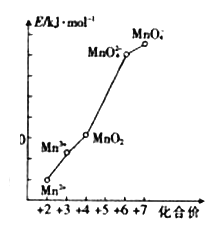
①MnO42-______(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,确认Mn2+存在的现象是______________________;检验时必须控制Mn2+的浓度和用量,否则实验失败,理由是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】生产措施与目的不相符的是
选项 | 生产措施 | 目的 |
A | 工业制硫酸:粉碎硫铁矿 | 提高反应的速率 |
B | 合成氨:铁触媒作催化剂 | 提高产物的产率 |
C | 海水提溴:热空气吹出Br2 | 提高Br2的纯度 |
D | 侯氏制碱:母液循环使用 | 提高原料利用率 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com