
科目: 来源: 题型:
【题目】下图所示转化关系(部分物质未列出)中,A的焰色反应呈黄色,C、D、E是常见气体且C、D是单质。
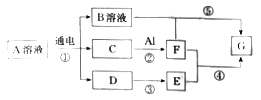
请回答下列问题:
(1)A的化学式为__________,电解时B在________极生成。
(2)工业上由D生成E的化学方程式为_____________。
(3)B溶液与G反应的离子方程式为_________________。
(4)上述转化中,属于非氧化还原反应的是__________(填数字代号)。
(5)取适量0.1mol/L 的F溶液,通入过量的E,现象是____________,充分反应后,所得溶液的pH=5.00,则此温度下残留在溶液中的c(Al3+)=________。[已知实验条件下Kap(G)=1.3×10-33]
查看答案和解析>>
科目: 来源: 题型:
【题目】V2O5是工业制硫酸的重要催化剂。V2O5及其含V离子在溶液中存在如下转化关系:
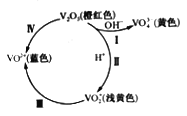
回答下列问题:
(1)从性质角度分类。V2O5属于_______(填“酸性”“碱性”或“两性”)氧化物,VO2+中钒元素的化合价为__________。
(2)写出反应Ⅰ的离子方程式:___________。
(3)向20mL 0.05mol/L (VO2)2SO4溶液中加入0.195g 锌粉,恰好完全反应,则还原产物中钒元素的存在形式为_________(填字母)。
a.V2+ b.V3+ c.VO2+ d.VO3-
(4)在酸性环境中,向含有VO2+的溶液中滴加草酸(H2C2O4)溶液,可实现反应Ⅲ的转化,写出该反应的离子方程式:__________。
(5)将V2O5加入浓盐酸中可得蓝色溶液,并有黄绿色气体生成,该反应中还原产物与氧化常务的物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
计算平衡时A的转化率__________和平衡常数___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:
As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O
①反应中还原剂是 , 被还原的元素是 , (用化学式回答)若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为L,
②用双线桥法标出上述反应中电子转移的方向和数目.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C. 生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列事实的解释错误的是 ( )
A. 氨气溶于水的喷泉实验,说明氨气极易溶于水
B. 常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化
C. 浓硝酸久置显黄色,说明浓硝酸不稳定
D. 向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁为四种主族元素,已知甲与乙、丙、丁三元素相邻;甲、乙的原子序数之和等于丙的原子序数,四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A. 原子半径:丙>乙>甲 B. 最外层电子数:丙=丁
C. 气态氢化物的稳定性:甲>丙 D. 最高价氧化物对应的水化物的酸性:丁>甲
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选 项 | 实验操作 | 实验现象 | 结 论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>苯酚 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3溶液的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (I)实验①和②探究HNO3浓度对该反应速率的影响 (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | _____ | _______ | __________ | |
③ | _____ | _______ | __________ | |
④ | _____ | _______ | __________ |
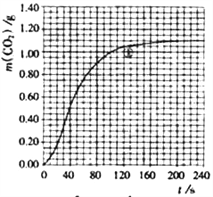
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式![]() CaCO3+HNO3=
CaCO3+HNO3=![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2↑+
CO2↑+![]() H2O,计算实验①在70-90 s范围内HNO3的平均反应速率____________,写出计算过程[忽略溶液体积变化,且70s时m(CO2)=0.84g,90s时m(CO2)=0.95g]。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率____________,写出计算过程[忽略溶液体积变化,且70s时m(CO2)=0.84g,90s时m(CO2)=0.95g]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com