
科目: 来源: 题型:
【题目】下列描述正确的是
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C. 可通过溶液导电能力的大小判断强弱电解质
D. 在NaHSO4溶液中存在的离子有:Na+、H+、HSO4-、OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2CO(g)=2C(s)+O2(g)的△H>0,△S<0,下列正确的是( )
A.低温下能自发进行B.高温下能自发进行
C.任何温度下都不能自发进行D.任何温度下都能自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关“化学与生活”的叙述不正确的是
A. 漂白粉漂白织物利用了物质氧化性
B. 点燃爆竹后,硫燃烧生成SO2
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于不饱和烃
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产工艺流程如下:

(1)操作1的操作是_________;
(2)升高pH至4.0~4.5的目的是_______________ ;
(3)生产过程中可回收使用的物质是__________(写物质名称);
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用______(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)通过该法得到一种化学式为[Al2(OH)2Cl45H2O]10的(M=320 g/mol)聚合氯化铝晶体,为测定产品纯度,进行如下操作:
①称取1.600g样品,用适量盐酸溶解后配成100.00 mL溶液;
②取25.00 mL溶液,控制pH=3.5,加入过量0.1 mol/L 40 mL EDTA(Na2H2Y2H2O)标准液滴定(Al3+ + H2Y2 = AlY + 2H+),加热煮沸5~10分钟,使Al3+与EDTA结合稳定(EDTA与Al3+结合无色);
③待上一步结束后,调节溶液pH至5~6,加入二甲酚橙作指示剂,用0.1 mol/L标准Zn2+溶液滴定多余的EDTA(Zn2+ + H2Y2 = ZnY2 + 2H+),消耗标准液20.00 mL(已知:二甲酚橙与Zn2+形成的配合物是红紫色的溶液)滴定终点的现象是_________________;产品的纯度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮、锌、汞的相关化合物在化工、医药、材料方面有着广泛的应用
(1)画出基态Zn原子的价电子排布图_________;
(2)在基态N原子中,核外电子占据的最高能层符号为________,占据该能层电子的电子云轮廓图形状为____________;
(3)Zn,Cd,Hg均为第ⅡB族元素,根据相对论收缩效应致,全满的6s壳层非常稳定,已知Hg原子的核外电子排布式为[Xe]4f145d106s2,请解释Hg在常温下为液态的原因_________________________;
(4)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:________________________________;
(5)纳米氧化锌是稳定的化合物,可以提供广谱的紫外保护(UVA和UVB),同时还有抗菌和抗炎的作用,一种氧化锌晶体具有ZnS型结构,边长为 a=0.446nm,求:
①Zn和O之间最短的距离为________nm;
②与Zn紧邻的O的个数为_______.
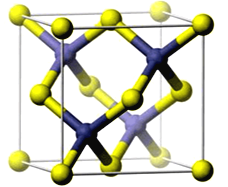
晶胞内部原子为Zn,顶点和面心原子为O
查看答案和解析>>
科目: 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。A的化学名称是______________。
(2)③、⑥的反应试剂和反应条件相同,分别是___________,反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙苯胺( ![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( ![]() )制备4-甲氧基乙苯胺的合成路线______________.(其他试剂任选)
)制备4-甲氧基乙苯胺的合成路线______________.(其他试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式为
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
A. 放电时负极反应式为Zn+2OH--2e- = Zn(OH)2
B. 放电时正极反应式为 FeO42-+4H2O+3e-= Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 充电时阳极附近溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com