
科目: 来源: 题型:
【题目】AlN广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. AlN为氧化产物
B. AlN的摩尔质量为41g
C. 上述反应中,每生成1molAlN需转移3mol电子
D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】依据阿伏加德罗定律,下列叙述中正确的是( )
A. 同温同压下,两种气体的体积之比等于摩尔质量之比
B. 同温同压下,两种气体的质量之比等于物质的量之比
C. 同温同压下,两种气体的物质的量之比等于密度之比
D. 同温同压下,两种气体的摩尔质量之比等于密度之比
查看答案和解析>>
科目: 来源: 题型:
【题目】根据教材中的“中和热的测定实验”,所用玻璃仪器除了烧杯、量筒、胶头滴管以外,还需要 . 已知:含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】向AlCl3溶液中逐滴滴加NaOH溶液至过量,该过程中可观察到的现象是( )
A.有无色气体放出
B.既有无色气体放出,又有白色沉淀生成
C.先产生白色沉淀,最后沉淀不溶解
D.先产生白色沉淀,最后沉淀溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是
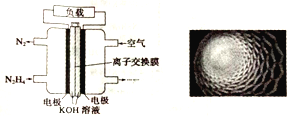
A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
①合成甲醇的反应为______(填“放热”或“吸热”)反应。

②A、B、C三点的平衡常数KA、KB、KC的大小关系为__________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_______________L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.____________

查看答案和解析>>
科目: 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用N2与Mg制备Mg3N2的装置如图所示(焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )

A. ①、②、③中依次盛装浓H2SO4溶液、NaOH溶液、焦性没食子酸溶液
B. 实验操作顺序为:通空气→管式电炉⑤通电加热→管式电炉④通电加热
C. ④的作用是预热经净化后的氮气
D. 当⑤的瓷舟中燃烧产生白光时,⑤可停止通电加热装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com