氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
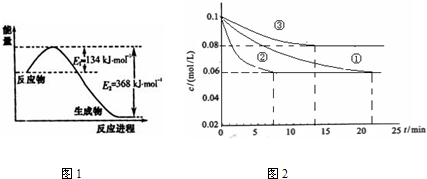
(1)图1是1mol NO
2和1mol CO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式
NO2(g)+CO(g)═CO2(g)+NO(g);△H=-234KJ/mol
NO2(g)+CO(g)═CO2(g)+NO(g);△H=-234KJ/mol
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H
+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N
2+3H
22NH
3,
阳极反应式为:3H
2-6e
-=6H
+,则阴极反应式为
N2+6H+=6e-+2NH3
N2+6H+=6e-+2NH3
.
(3)工业中常用以下反应合成氨:N
2+3H
2?2NH
3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c (N
2)=0.1mol/L,c (H
2)=0.3mol/L进行反应时,N
2的浓度随时间的变化如下图①、②、③曲线所示.
I.该反应实验②平衡时H
2的转化率为
40%
40%
.
II.据图2所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.③条件:
②与①相比加了催化剂;③与①相比温度升高
②与①相比加了催化剂;③与①相比温度升高
理由:
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以①②两装置达到平衡时N2的浓度相同;
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以①②两装置达到平衡时N2的浓度相同;
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
.
(4)I.NH
4Cl溶液呈酸性,这是由于NH
4+水解的缘故.则NH
4Cl溶于重水(D
2O)生成一水合氨和水合氢离子的离子方程式是
NH4++D2O=NH3?HDO+D3O+
NH4++D2O=NH3?HDO+D3O+
.
II.常温下,0.1mol?L
-1氨水与0.1mol?L
-1盐酸溶液等体积混合(忽略混合后溶液体积的变化),则混合溶液中由水电离出的c(H
+)
>
>
0.1mol?L
-1氨水溶液中由水电离出的c(OH
-)(填写“>”“=”或“<”)



 ),它是一种白色晶体,易溶于水,有特殊鲜味.谷氨酸钠在100℃下加热3小时,分解率仅为0.3%,而在较高温度(超过120℃)下长时间加热就会分解生成有毒的焦谷氨酸钠.且谷氨酸钠可与血液中的锌结合生成谷氨酸锌,随尿液排出体外.则下列有关叙述中正确的是( )
),它是一种白色晶体,易溶于水,有特殊鲜味.谷氨酸钠在100℃下加热3小时,分解率仅为0.3%,而在较高温度(超过120℃)下长时间加热就会分解生成有毒的焦谷氨酸钠.且谷氨酸钠可与血液中的锌结合生成谷氨酸锌,随尿液排出体外.则下列有关叙述中正确的是( )