
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
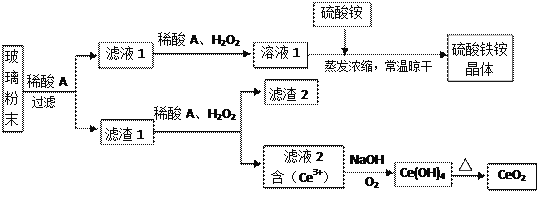
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是_________________________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为___________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式_____________________________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理。相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。
该产品中Ce(OH)4的纯度为__________________。(保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】向盛有NaBr溶液的试管中加入少量氯水,振荡,再加入适量CCl4,振荡,静置。下列判断正确的是
选项 | A | B | C | D |
上层 | 红棕色 | 黄绿色 | 无色 | 无色 |
下层 | 无色 | 无色 | 红棕色 | 黄绿色 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 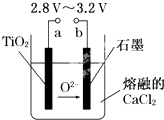
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】用5mL的0.2 mol·L—1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化沉淀,则三种硫酸盐溶液物质的量浓度之比是( )
A. 3:2:1 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将4 mol A和8 mol B加入体积为2 L的某密闭容器中,反应至4 min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是
2C(g)+D(g)。现将4 mol A和8 mol B加入体积为2 L的某密闭容器中,反应至4 min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是
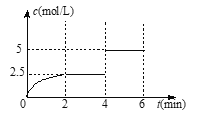
A. 0~2 min内,正反应速率逐渐增大
B. 4 min时,A的转化率为50%
C. 6 min时,B的体积分数为25%
D. 4 min时,改变条件后,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】升高温度时,化学反应速率加快原因的合理解释是
A.该化学反应的过程是吸热的
B.该化学反应的过程是放热的
C.分子运动速率加快,使反应物分子的碰撞机会增多
D.反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com