
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B. 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
C. CH3COOH 溶液加水稀释后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解向左移动,溶液的pH 增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的工业制法正确的是
A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛
B.炼铁:炼铁高炉中碳在高温下还原铁矿石中的铁
C.制钠:用海水作原料制得精盐,再电解熔融的氯化钠得到金属钠
D.炼硅:用焦炭与二氧化硅在高温下反应生成粗硅和二氧化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子中,能在无色透明溶液中大量共存的是
A. Na+、H+、Cl-、OH- B. K+、Na+、CO32-、OH-
C. K+、SO42-、NO3-、MnO4- D. Na+、HCO3-、H+、Ca2+
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氨基酸的叙述错误的是( )
A. 氨基酸的结构中都含有氨基和羧基
B. 人体内氨基酸代谢的最终产物是二氧化碳和尿素
C. 人体内所有氨基酸都可以相互转化
D. 两个氨基酸通过脱水缩合形成二肽
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n,M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)B2﹣的离子结构示意图 , DE2的电子式 .
(2)A、B形成的简单离子的半径由大到小的顺序为(用具体符号表示).
(3)A、E形成的是(填共价或离子)化合物
(4)C在周期表中的位置是
(5)由元素C形成的单质Y与由A,B,F三种元素形成的化合物X的水溶液反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,48g O3所含的原子数为3NA
B. 1mol NH3所含有的原子数为NA
C. 标准状况下,22.4L水中所含原子数为3 NA
D. 0.1mol/L NaC1溶液中所含Na+数目为0.1 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】0.1mol金属锡跟100mL12mol/LHNO3共热一段时间,完全反应后放出气体0.4mol,测定溶液c(H+)=8mol/L,溶液体积仍为100mL。由此推断氧化产物可能是
A. Sn(NO3)2 B. Sn(NO3)4
C. SnO24H2O D. Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究. 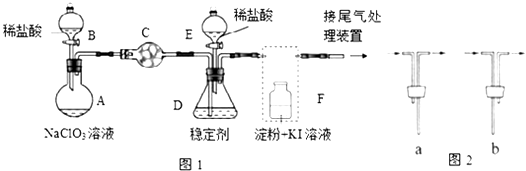
(1)仪器D的名称是 , 仪器E的名称是 . 安装F中导管时,应选用图2中的 .
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,这个反应中氧化剂和还原剂的物质的量之比为 , 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是 .
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为 , 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 .
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是 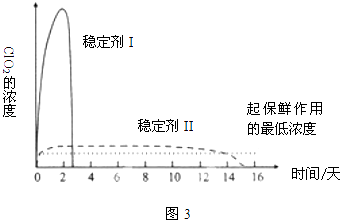
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com