
科目: 来源: 题型:
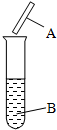 用试纸检验气体性质是一种重要的实验方法.如图所示,下列试纸选用、现象、对比结论都正确的一项是( ) 用试纸检验气体性质是一种重要的实验方法.如图所示,下列试纸选用、现象、对比结论都正确的一项是( )
|
查看答案和解析>>
科目: 来源: 题型:
根据下列实验内容得出的结论正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
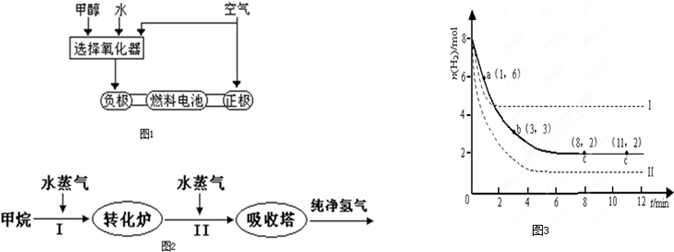
| 高温 |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:| c(C6H5CH=CH2)c(H2) |
| c(C6H5C2H5) |
| c(C6H5CH=CH2)c(H2) |
| c(C6H5C2H5) |
查看答案和解析>>
科目: 来源: 题型:
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
查看答案和解析>>
科目: 来源: 题型:
蛇纹石矿可看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制碱式碳酸镁的实验步骤如下: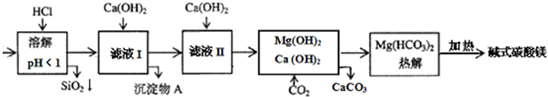 室温下,相关金属氢氧化物沉淀的KSP见下表1
|
查看答案和解析>>
科目: 来源: 题型:
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )查看答案和解析>>
科目: 来源: 题型:
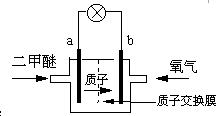 日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com