
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2 L的戊烷所含的分子数为0.5NA
B. 28 g乙烯所含共用电子对数目为4NA
C. 11.2 L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】既能与稀硫酸反应,又能与NaOH溶液反应的是( )
①SiO2 ②Al ③NaHCO3 ④Al2O3 ⑤(NH4)2CO3
A.全部B.②④⑤C.②③④⑤D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知:
①CO(g)+0.5O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
则处理CO、SO2的方法的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。
(4)已知下列热化学方程式:
①![]() △H=-285.8kJ/mol
△H=-285.8kJ/mol
②![]() △H=-241.8kJ/mol
△H=-241.8kJ/mol
则H2的燃烧热(△H)为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污 水工艺的流程如下:

(1)请写出N2H4的电子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①己知含铬废水中存在着平衡,Cr2O72-和CrO42-在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.稀豆浆、硅酸、氧化铁溶液都属于胶体
B.Na2O、MgO、Al2O3均属于碱性氧化物
C.氨水、次氯酸都属于弱电解质
D.通过化学反应,可由Ba(OH)2一步转化生成NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)纯水在T ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_______mol·L-1。
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A)___pH(B) (填“>”、“=”或“<”);
现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) _____V(B)(填“>”、“=”或“<”)。
(3)25℃时,0.05mol/LH2SO4溶液的pH=_________;0.05mol/LBa(OH)2溶液中的c(H+)=_______。
(4)某温度下纯水中的c(H+)=2×10-7mol/L,则此时水中的c(OH-)=____________;若温度不变,滴入稀盐酸,使c(H+)=5×10-4mol/L,则溶液中c(OH-)=_________,此时溶液中由水电离产生的c(H+)=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaI用作制备无机和有机碘化物的原料,也用于医药和照相等,工业利用碘、氢氧化钠和铁屑为原料可生产NaI,其生产流程如下图。
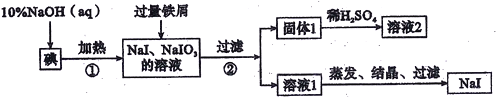
(1)碘元素在周期表中的位置为______________________。
(2)反应①的离子方程式为___________________________________________。
(3)反应②加入过量铁屑的目的是_________________,过滤所得固体1中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式为____________________________________。
(4)溶液2中除含有H+外,一定还含有的阳离子是_______________;试设计实验验证溶液2中该金属阳离子的存在:___________________________________________。
(5)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180),称取3.60 g草酸亚铁晶体,用热重法对其进行热分解(隔绝空气加热),得到剩余固体的质量随温度变化的曲线如右图所示:
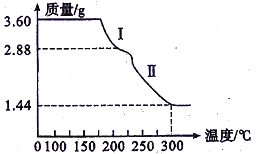
①分析图中数据,根据信息写出过程I发生的化学方程式:_________________________________。
②300℃时剩余固体只含一种成分且是铁的氧化物,写出过程II发生的化学方程式: ________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1) 基态硅原子的电子排布图为_________________________________________________;硫的基态原子能量最高的电子云在空间有________________个伸展方向,原子轨道呈________________形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________,其分子的空间构型为________________。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________;PO43-作为___________为Fe3+提供________________。
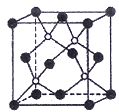
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为_________g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方法正确的是
①用水鉴别四氯化碳、苯和乙醇
②用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
③用闻气味的方法鉴别化纤织物和纯毛织物
④用碘水检验淀粉
⑤用蒸馏法分离乙酸乙酯和饱和碳酸钠溶液
A.①④ B.③④ C.②③ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com