
科目: 来源: 题型:
【题目】在水溶液中能大量共存的离子组是
A.Al3+ H+ HCO3- B.Na+ NO3- Cl-
C.H+ OH- SO42- D.Ca2+ K+ CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用20gNaOH配制成500mL溶液.
(1)该NaOH溶液的物质的量浓度是;
(2)从中取出1mL,其物质的量浓度是 , 含NaOH的质量是;
(3)若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度是 , 含NaOH的质量是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O △H=-1530.6kJmol-1。
2N2(g)+6H2O △H=-1530.6kJmol-1。
①合成氨反应的热化学方程式为__________________________________。
②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。
(2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g)![]() CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
①0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出23 min内c(NH3)随时间(t)变化的曲线关系图:__________。
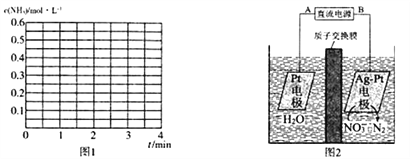
(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示:
①电源正极为___________(填“A”或“B”),阴极反应式为________________________________。
②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂用软锰矿(主要为MnO2,含杂质Al2O3和闪锌矿(主要为ZnS,含杂质FeS) 共同生产干电池的原料Zn和MnO2,同时获得一些副产品,工艺流程如下:
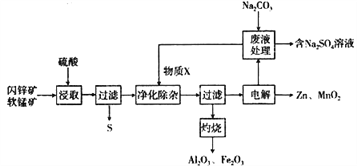
已知:硫酸浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3
(1)“浸取”时发生的反应中,还原产物为_______________ (填化学式)。
(2)①“净化除杂”时,加入的物质X可能为______________(填选项字母)。
A.MnCO3 B. Zn2(OH)2CO3 C.NaOH D. KOH
②相关离子开始沉淀和完全沉淀的pH如下表所示,加入X后,溶液pH应调整到________。
离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 2.3 | 3.2 |
A13+ | 4.2 | 5.4 |
Zn2+ | 7.2 | 8.0 |
Mn2+ | 8.3 | 9.8 |
(3)只用一种试剂,即可从 “灼烧”所得的Fe2O3和Al2O3混合物中分离得到Fe2O3。该反应
的离子方程式为____________________________________。
(4)“电解”时,发生反应的化学方程式为____________________________________。
(5)从Na2SO4溶液中得到芒硝晶体(Na2SO4 10H2O),需要进行的实验操作有______、_____、过滤、洗涤、干燥等.
(6)Zn和MnO2的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为________________________________。
(7)用生产的Zn和MnO2制成干电池,在碱性条件下工作时有MnOOH生成,则该电池正极的电极反应式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com