
科目: 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ ![]() O2(g)
O2(g) ![]() SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A. 196.64kJ B. 196.64kJ/mol
C. <196.64kJ D. >196.64kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知; CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
H2(g)+ ![]() O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。
CH3OH的燃烧热△H=_______。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:
CO2(g)+CH4(g)![]() CH3COOH(g) △H=+36.0 kJ/mol
CH3COOH(g) △H=+36.0 kJ/mol
在不同温度下乙酸的生成速率变化如右图所示。
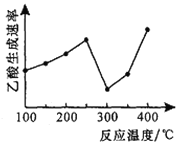
①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是______,当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是________。
②欲使乙酸的平衡产率提高,应采取的措施是________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应: C(s)+CO2(g)![]() 2CO(g)。
2CO(g)。
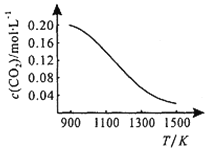
①向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示。则该反应为_____(填“放热”或“吸热”)反应,某温度下,若向该平衡体系中再通入0.2molCO2,平衡____(填“正向”“逆向”“不”)移动,达到新平衡后,体系中CO的百分含量________ (填“变大”“变小”“不变”)。
②向压强为p体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________(用含p的代数式表示),若向平衡体系中再充入V(CO2): V(CO)=5:4的混合气体,平衡______(填“正向”“逆向”“不”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属腐蚀的叙述正确的是( )
A.本质是:2M +2 nH2O = 2M(OH)n+ n H2↑
B.电化学腐蚀必须在酸性条件下进行
C.化学腐蚀比电化学腐蚀更普遍
D.本质是:M – ne-= Mn+
查看答案和解析>>
科目: 来源: 题型:
【题目】铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯.如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg.那么一个铅笔字含有的碳原子数约为( )
A.2.5×1019个
B.2.5×1022个
C.5×1019个
D.5×1022个
查看答案和解析>>
科目: 来源: 题型:
【题目】有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列说法不正确的是( )
A. M与R的质子数之和一定等于19 B. M、R可能分别处于第二周期和第三周期
C. M、R可能分别处于第六主族和第一主族 D. M和R的质子数之差可能等于7
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意填空
(1)9.8克SO42﹣的物质的量为 , 质子数为个(用NA表示)
(2)在3S+6KOH═2K2S+K2SO3+3H2O的反应中,氧化剂还原剂 , 氧化剂与还原剂的质量之比为 .
(3)在标准状况下,33.6L的NH3将其溶解于水配成1L的溶液,则溶液的物质的量浓度为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下两个容积相等的贮气瓶,一个装有CO,一个装有N2和CO2的混合气体,两瓶气体一定相同的是( )
A.物质的量和质量
B.原子总数
C.分子总数
D.密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com