
科目: 来源: 题型:
【题目】已知破坏1mol H﹣H键、1mol I﹣I键、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成2mol HI需要放出________kJ的热量.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 钠、硅、硫等元素在自然界中只存在化合态
B. 纯铁的抗腐蚀性能比生铁好
C. 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放
D. 制备FeCl3不能采用将其溶液直接蒸干的方法
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
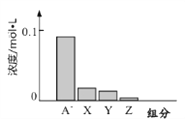
A. HA为强酸 B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A—)+ c(Y)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列实验各装置图的叙述,不正确的是( ) 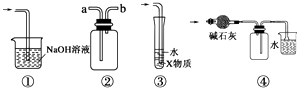
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为苯,可用于吸收氨气或氯化氢
D.装置④中可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中加入少量固体Na,平衡逆向移动,c(H+)降低,KW不变
D. 将水加热,KW增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ可逆反应2SO2(g)+O2(g)===2SO3(g)是工业上制取H2SO4的重要反应。
(1)在恒压条件下,该反应分组实验的有关条件如下表:
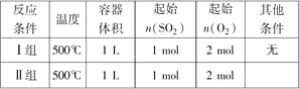
已知Ⅰ、Ⅱ两组实验过程中,SO3气体的体积分数φ(SO3)随时间t的变化曲线如图所示

①Ⅱ组与Ⅰ相比不同的条件是________
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间________(填“小于”、“大于”或“等于”)t1
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是________
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁 C.乙、甲、丁、丙 D.丁、丙、乙、甲
Ⅱ 根据外界条件对化学平衡的影响回答下列问题:
(1)碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)![]() I3-(aq),下列说法不正确的是________(填字母序号,下同)。
I3-(aq),下列说法不正确的是________(填字母序号,下同)。
a.上述体系中加入苯,平衡不移动
b.可运用该反应原理除去硫粉中少量的碘单质
c.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
d.加入AgNO3溶液平衡向左移动
(2)某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①下列分析正确的是________。
a.平衡后,加入N2,该反应的ΔH增大
b.平衡后,加入催化剂,该反应的ΔH不变
c.平衡后,充入NH3,新平衡时,NH3的百分含量变大
d.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
②欲提高H2的转化率,下列措施可行的是________。
a.缩小容器体积
b.向容器中按原比例再充入N2和H2
c.向容器中再充入惰性气体
d.改变反应的催化剂
e.液化NH3并分离
查看答案和解析>>
科目: 来源: 题型:
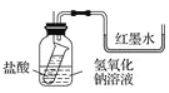
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是______________________________
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
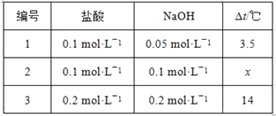
则x=______
(3)若HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】2012年中国汽车销量大幅增长,同时也带来了严重的空气污染.汽车尾气装置中,气体在催化剂表面吸附与解吸的过程如图所示,下列说法正确的是( ) 
A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com