
科目: 来源: 题型:
【题目】由铁、石墨、稀盐酸组成的原电池工作时,下列叙述正确的是( )
A. 铁电极为负极 B. 石墨电极为负极
C. 氢离子向铁电极移动 D. 正极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中含有大量的下列离子:Mg2+、NO3—、K+和M离子,经测定Mg2+、NO3—、K+离子的物质的量之比为2︰4︰1,则M离子可能是下列中的
A. Cl— B. SO42- C. OH— D. Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】[物质结构与性质]2016年9月南开大学学者首次测试了一种新型锌离子电池,该电池以Zn(CF3SO3)2为电解质,用有阳离子型缺陷的ZnMn2O4为电极,成功的获得了稳定的大功率电流。
(1)写出Mn原子基态核外电子排布式 。
(2)CF3SO3H是一种有机强酸,结构式如图1所示,通常用 CS2、IF5、H2O2等为主要原料制取。
①1molCF3SO3H分子中含有的σ键的数目为 mol。
②H2O2分子中O原子的杂化方式为 。与CS2互为等电子体的分子为 。
③IF5遇水完全水解生成两种酸,写出相关化学方程式: 。
(3)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2,该晶胞中S2-的配位数为 。
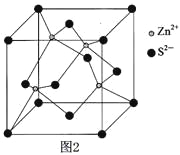
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表是元素周期律的具体表现形式
查看答案和解析>>
科目: 来源: 题型:
【题目】电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO3-含量会增加。
已知:Ⅰ.NaHCO3固体50℃开始分解,在溶液中分解温度更低。
Ⅱ.碱性条件下,ClO-有强氧化性,ClO3-性质稳定。
Ⅲ.酸性条件下,ClO3-被Fe2+还原为Cl-,MnO4-被Fe2+还原为Mn2+。
(1)氯酸盐产生的原因可表示为3ClO-![]() 2Cl-+ClO3-,该反应的平衡常数表达式为 。
2Cl-+ClO3-,该反应的平衡常数表达式为 。
(2)测定电解盐水中ClO3-含量的实验如下:
步骤1:量取盐水样品V mL,调节pH至9~10,再稀释至500 mL。
步骤2:取10.00 mL稀释后的试液,滴加5%的双氧水,至不再产生气泡。
步骤3:加入饱和NaHCO3溶液20 mL,煮沸。
步骤4:冷却,加足量稀硫酸酸化。
步骤5:加入a mol·L-1FeSO4溶液V1 mL(过量),以如图所示装置煮沸。

步骤6:冷却,用c mol·L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V2mL。
①稀释时用到的玻璃仪器有烧杯、胶头滴管、 。
②步骤2用双氧水除去盐水中残留ClO-的离子方程式为 ,还原剂不用Na2SO3的原因为 。
③与步骤5中通N2目的相同的实验是 (填写步骤号)。
④该盐水试样中ClO3-的浓度为 mol·L-1(用含字母的代数式表示)。
⑤为提高实验结果的精确度,还需补充的实验是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列用途主要是体现铝的物理性质的是( ):①家用铝锅 ②盛浓硝酸的容器 ③ 制导线 ④焊接钢轨 ⑤包装铝箔 ⑥制成合金作飞机制造业材料 ⑦工业上做热交换器
A. 只有①②③④ B. 只有④⑥⑦
C. 只有①③⑤⑥⑦ D. 只有②④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两组物质,在一定条件下,甲组中能和乙组中各物质都起反应的是
甲组:A.甲酸 B.乙酸钠 C.乙酸乙酯 D.苯酚
乙组:E.NaOH F.溴水 G.甲醛 H.FeCl3
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。

(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。

③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )
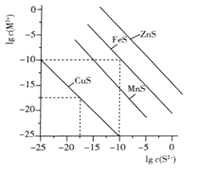
A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com