
科目: 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用3.0 mol·L-1的硫酸溶液与锌粒反应制取氢气。下列措施中可能加大反应速率的是
A.适当降低温度B.将锌粒改为锌粉
C.将所用硫酸换成98%的浓硫酸D.加入少量醋酸钠固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钠及其化合物的说法正确的是
A. 钠的密度比水大 B. 碳酸氢钠可用于治疗胃酸过多
C. 钠着火可用湿布盖灭 D. 过氧化钠露置于空气中最终会变成氢氧化钠
查看答案和解析>>
科目: 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液2a L分成两等份.一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3﹣的浓度为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
(1)Ⅰ、将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式 .
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: .
(3)Ⅱ、利用如图装置可以验证非金属性的变化规律. 
实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为 , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 .
(4)若要证明非金属性:S>C>Si,则A中加 , B中加Na2CO3 , C中加 , 则观察装置C中的实验现象为有白色沉淀生成.离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O物质的量之比为1∶2的混合溶液浸取锌焙砂时,生成[Zn(NH3)4]2+,该反应的离子方程式是 。浸取过程加入H2O2的目的是 。
(2)适量S2-能将Cu2+等离子转化为硫化物沉淀而除去,若选择置换的方法除杂,则应加入的物质为 。
(3)气体A的化学式是 。
(4)过滤3所得滤液可循环使用,其主要成分的化学式是 。证明2Zn(OH)2·ZnCO3沉淀洗涤完全的方法是 。
(5)为实现循环生产,下列物质中可以用来代替(NH4)2S完成除杂的是 。(填字母)
a.Na2S b.K2S c.BaS
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是
A.成键过程中吸收能量
B.断键过程中吸收能量,成键过程中释放能量
C.断键过程中释放能量
D.断键过程中释放能量,成键过程中吸收能量
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
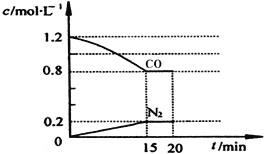
①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于摩尔质量的说法正确的是
A. 水的摩尔质量是18g
B. 任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
C. 2mol水的摩尔质量是1mol水摩尔质量的2倍
D. 水的摩尔质量是氢气摩尔质量的9倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com