
科目: 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤,甲烷等可以与水蒸气反应生成以CO 和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应向_______进行(填“左”或“右”),判断依据是________________________。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
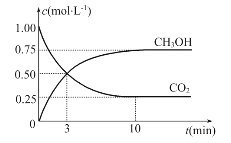
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②反应达到平衡后,下列措施能使![]() 增大的是____________(填符号)。
增大的是____________(填符号)。
A.升高温度B.再充入H2 C.再充入CO2D.将H2O(g)从体系中分离 E.充入He(g)
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H = +206.4 kJ·mol-1
CO(g)+3H2(g) △H = +206.4 kJ·mol-1
②CO(g)+ H2O(g)![]() CO2(g) +H2(g) △H = -41.2 kJ·mol-1
CO2(g) +H2(g) △H = -41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 ____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于百年经典药物阿司匹林的叙述正确的是( )
A. 阿司匹林的化学名为乙酰水杨酸
B. 阿司匹林属于抗生素
C. 阿司匹林是一种白色晶体,易溶于水
D. 阿司匹林之所以成为经典药物是因为该服用药物没有不良反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( ) 
A.由于
A.B两电极没有活动性差别,不能构成原电池
B.A电极是负极,电极上发生氧化反应
C.产物为无污染的水,属于环境友好的绿色电池
D.外电路中电流由B电极通过导线流向A电极
查看答案和解析>>
科目: 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。
已知:C(石墨,s)+O2(g)═CO2(g) △H=-394k J/mol
2C(石墨,s)+O2(g)═2CO(g) △H=-222k J/mol
H2(g)+1/2O2(g)═H2O(g) △H=-242k J/mol
则CO还原H2O(g)的热化学方程式为_________________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。
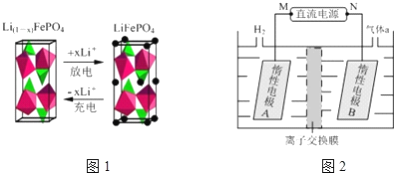
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜。
(5)上图所示装置(阴、阳极均为惰性电极)可用于电解尿素(CONH2)2)的碱性溶液制取氢气。该装置中阳极的电极反应式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S ![]() 6Cu+SO2↑,对于该反应,下列说法正确的是( )
6Cu+SO2↑,对于该反应,下列说法正确的是( )
A. 该反应的氧化剂只有Cu2O
B. Cu既是氧化产物又是还原产物
C. 每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D. 该反应中氧化产物与还原产物的质量比为1∶6
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________;该温度下 平衡常数K=___________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
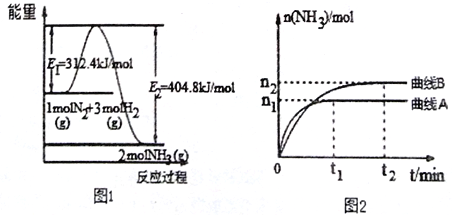
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PAB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KAB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的![]() 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
查看答案和解析>>
科目: 来源: 题型:
【题目】用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是( )
A.C原子的四个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤对电子占据
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com