
科目: 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:_________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为___________,滴定终点观察到的现象为_______________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__________,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会___________(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/LCuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=_____ mol/L;
(4)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②_______________________;③过滤;
④______________________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图A、B、D、E的转化关系,回答下列问题: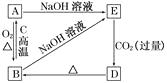
(1)写出A、D的名称:A , D。
(2)写出B→A的化学方程式:。
(3)写出下列反应的离子方程式:A→E:;E→D:。
查看答案和解析>>
科目: 来源: 题型:
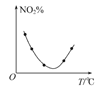
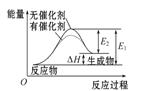
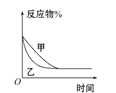
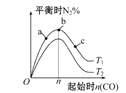
【题目】下列图示与对应的叙述不相符的是
![]()
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
查看答案和解析>>
科目: 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选30℃
C. 第二阶段,Ni(CO)4分解率较高
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,下列说法错误的是

A. 上图所涉及到的化学反应都是氧化还原反应
B. N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C. NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D. 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中的每一方格表示相关的一种反应物或生成物。其中B是一种单质,其余物质也都是有B元素的化合物。C是一种钠盐,E是C对应的酸,B的结构类似金刚石,D为B的氧化物(其他不含B元素的反应产物以及各步反应添加的必要试剂和反应条件已被略去),请填写空白: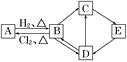
(1)A、D、E的化学式分别为、、。
(2)A和B的互相转化在工业上有什么实际意义?
。
(3)写出D→C反应的化学方程式:
。
(4)写出E→D反应的化学方程式:。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2X为二元弱酸,常温下,0.1 mol/L的NaHX溶液中c(H+) > c(OH-),下列关系中一定正确的是
A. c(Na+) + c(H+) = c(HX-) + 2c(X2-) B. c(H+)·c(OH-) = 10-14 mol2·L-2
C. c(Na+) = c(X2-) + c(HX-) D. 溶液中pH = 1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列现象与盐类水解无关的是
A.将Al粉投入到H2SO4溶液中,有气泡生成
B.配制FeC13溶液时适当加入少量盐酸
C.明矾可作净水剂
D.泡沫灭火器用Al2(SO4)3,与NaHCO3为原料
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 在熔融状态下,1 mol KHSO4完全电离出的阳离子数目为2NA
B. 7.8 g Na2O2含有的阴离子数目为0.2NA
C. 14 g乙烯和14 g丙烯中均含有3NA对共用电子对
D. 分别处于第二、三周期的两种元素的原子各1 mol,其最外层电子数最多相差8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如下图是常见仪器的部分结构。
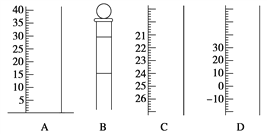
(1)写出仪器名称A___________,B_________,C__________,D__________。
(2)使用前需检查是否漏水的仪器有__________。
(3)某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上 2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
①正确操作步骤的顺序是__________________________(用字母序号填写)。
②上述B步骤操作的目的是____________________________________________。
③上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果_______(填“偏高”、“偏低”或“不变”)。
④判断到达滴定终点的实验现象是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com